Benutzer:Thomas Lux: Unterschied zwischen den Versionen
| Zeile 468: | Zeile 468: | ||
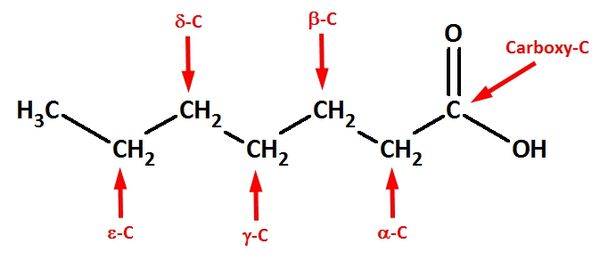
{{versteckt|Lactone sind intramolekulare Ester, die von Molekülen gebildet werden, die im geöffneten Zustand sowohl eine Hydroxy- wie auch Carboxygruppe besitzen. Die griechischen Buchstaben geben Auskunft über die Stellung der Hydroxygruppe zur Carboxygruppe: Ist die Hydroxygruppe an einem C-Atom gebunden, das direkt neben dem Carboxy-C-Atom liegt, spricht man von einer <math>\alpha</math>-Hydroxycarbonsäure (diese können keine intramolekularen Ester bilden!). Hängt die Hydroxgruppe an einem C-Atom, das zwei C-Atome vom Carboxy-C-Atom entfernt ist, spricht von <math>\beta</math>-Hydroxycarbonsäuren (diese bilden <math>\beta</math>-Lactone) usw. }} <br> | {{versteckt|Lactone sind intramolekulare Ester, die von Molekülen gebildet werden, die im geöffneten Zustand sowohl eine Hydroxy- wie auch Carboxygruppe besitzen. Die griechischen Buchstaben geben Auskunft über die Stellung der Hydroxygruppe zur Carboxygruppe: Ist die Hydroxygruppe an einem C-Atom gebunden, das direkt neben dem Carboxy-C-Atom liegt, spricht man von einer <math>\alpha</math>-Hydroxycarbonsäure (diese können keine intramolekularen Ester bilden!). Hängt die Hydroxgruppe an einem C-Atom, das zwei C-Atome vom Carboxy-C-Atom entfernt ist, spricht von <math>\beta</math>-Hydroxycarbonsäuren (diese bilden <math>\beta</math>-Lactone) usw. }} <br> | ||
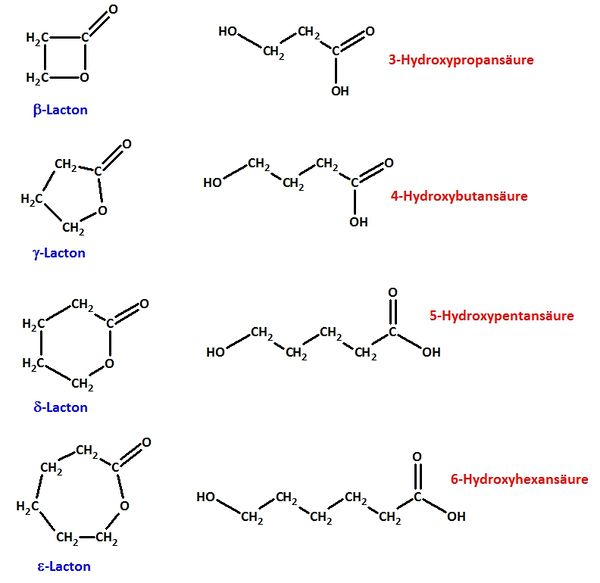
Veranschaulichung: <br> | Veranschaulichung: <br> | ||
| − | {{versteckt|[[Datei:4_Hydroxycarbonsäuren_a_e.jpg| | + | {{versteckt|[[Datei:4_Hydroxycarbonsäuren_a_e.jpg|600px]]}} <br> |
bb) Zeichne von allen abgebildeten Lactonen das geöffnete Molekül (die „Hydroxy-Carbonsäuren“) und benenne sie systematisch! <br> | bb) Zeichne von allen abgebildeten Lactonen das geöffnete Molekül (die „Hydroxy-Carbonsäuren“) und benenne sie systematisch! <br> | ||
{{versteckt|[[Datei:4_Lactone_a_e.jpg|600px]]}} <br> | {{versteckt|[[Datei:4_Lactone_a_e.jpg|600px]]}} <br> | ||
Version vom 26. Juni 2012, 22:02 Uhr
Meine Benutzerseite ist lediglich eine Art "Steinbruch". Hier liegen hauptsächlich links zu (für mich) wichtigen RMG-Wiki-Seiten und verschiedene Formatvorlagen.
interne links
Seminare
Recherchiert Informationen zum Thema "Schokolade". Überlegt euch den Titel für eine fiktive Arbeit und schreibt eine Einleitung: Eine DIN-A4-Seite; Schriftgröße 12; Zeilenabstand 1,5; linker Rand: 4 cm; rechter Rand 3 cm; oberer und unterer Rand 2 cm.
Sonstiges
hochzuladende Einheiten
Neu, 30.05.11: Buch, S. 112 - 113
- 3.4.8 Mutationen und Krebs als pdf-Datei
- 3.5 Gentechnik
- 3.5.1 Gentechnische Werkzeuge und Verfahren als pdf-Datei
Test Lizenzen
Test: Blue Genes 2008
Chemie-Grundwissen
Grundwissen Chemie: 8. Klasse NTG
Grundwissen Chemie: 10. Klasse NTG
30px Versuch
{{{1}}} |
Wasserstoff und Sauerstoff reagieren zu Wasser:
2 H2 + O2 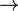 2 H2O
2 H2O
2 H2 + O2 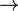 2 H2O
2 H2O
Test 3: Animakes
LK Bio
Sozialverhalten: pdf-Datei
|
|
|
|
Hinweise für Referate
- Die Referate sollen 5 Minuten dauern! (Zeitüber- u. -unterschreitung führt zu Punktabzug (s. Bewertungskriterien)
- Das Thema ist absichtlich sehr weit gefasst. - Es ist EURE Aufgabe einen Schwerpunkt zu setzen! Die Wikipediartikel sind teilweise sehr anspruchsvoll - in dieser Form könnt ihr die Informationen NICHT der Klasse präsentieren! - Wenn ihr die chemischen Details nicht versteht: PRÄSENTIERT SIE NICHT! - Ihr könnt jeder Zeit auf ein Randthema ausweichen! - Bsp.: Ihr findet auf den Wikipedia-Seiten zu Cyclohexanon einiges über die chemischen Mechanismen der Herstellung und Weiterverarbeitung. - Das wäre wahrscheinlich langweilig oder zu schwer zu verstehen. Ihr findet aber auch, dass man aus Cyclohexanon als Ausgangsstoff zur Perlonherstellung verwendet, ein Stoff, der für Fallschirme benötigt wird. Es ist durchaus möglich das Thema dann auf Fallschirme zu lenken!
- Die Kriterien zur Bewertung Eures Vortrages könnt ihr hier einsehen: Bewertungskriterien als pdf-Datei.
- Ein dort nicht aufgeführtes Kriterium ist das einzuhaltende Niveau! Es ist immer besser sich einen Aspekt herauszugreifen und den so detailliert wie möglich auszuschöpfen anstatt 5 Minuten einen Überblick zu geben, bei dem immer nur an der Oberfläche gekratzt wird!
- Entspricht das Referat im Wesentlichen dem Wikipedia-Eintrag zu diesem Thema, werden für den Punkt "Aufbau, Inhalt, Gliederung" 0 Pkt. vergeben.
- Wer sein Referat am festgelegten Termin nicht halten kann, hat die Möglichkeit bis zur Unterrichtsstunde davor den Termin zu verschieben oder eine e-mail zu schreiben. Wer am Tag selbst (z. B. aufgrund von Krankheit) fehlt, muss die üblichen Bestimmungen zur Entschuldigung einhalten (spätestens am 3. Tag nach Beginn der Erkrankung muss der Schule eine schriftliche Entschuldigung vorliegen). In allen anderen Fällen wird die Leistung mit der Note 6 bewertet.
- In der Regel können die vorhandenen Computer die meisten Dateien von Schülern verarbeiten. Zur Sicherheit empfehle ich jedoch mir die Präsentation am Tag vorher (bis spätestens 18:00 Uhr) per e-mail zu schicken. Ihr erhaltet dann eine Bestätigungsmail und ich übernehme die Verantwortung dafür, dass die Präsentation funktioniert. Wer darauf verzichtet und am Präsentationstag technische Probleme hat (USB-Stick passt nicht, Datei kann nicht gelesen werden, Verbindungskabel funktioniert nicht) muss das Referat ohne Präsentation halten!
- Wer mir eine e-mail schreibt, sollte die grundlegendsten Höflichkeitsformen einhalten! - Die e-mail muss einen Betreff enthalten, sonst öffne ich sie nicht, schon gleich gar nicht, wenn aus der e-mail-adresse nicht die Identität des Absenders hervorgeht! Ihr solltet mit einer Grußformel (z.B. "Hallo Herr Lux") beginnen. Die Form "hey jo, was gehtn..." akzeptiere ich nicht mehr!
| Name | Thema | Datum | gehalten |
|---|---|---|---|
| n. n. | Vitamin C | 28.06. | V |
| n. n. | Buttersäure | 28.06. | V |
| n. n. | Moschus | 28.06. | V |
| n. n. | Zitronensäure | 29.06. | V |
| n. n. | Salicylsäure | 29.06. | V |
| n. n. | Weinsäure | verschoben auf 06.07. | V |
| n. n. | Äpfelsäure | 30.06. | V |
| n. n. | Essigsäure | 30.06. | V |
| n. n. | Benzoesäure | 30.06. | V |
| n. n. | Ameisensäure | 05.07. geht nicht --> Englisch-Test verschoben auf 06.07. |
V |
| n. n. | Benzaldehyd | 05.07. geht nicht --> Englisch-Test verschoben auf 06.07. |
V |
| n. n. | Vanillin | 05.07. geht nicht --> Englisch-Test verschoben auf 06.07. |
V |
| n. n. | Zimtaldehyd | 06.07. Verschiebung nötig! neu: am 07.07. |
O |
| n. n. | Cyclohexanon | 06.07. Verschiebung nötig! neu: am 07.07. |
V |
| n. n. | Vorschlag: Decanal |
06.07. Verschiebung nötig! neu: am 07.07. |
V |
W-Seminar 2011/2013
Lösungen zu den Aufgaben
Durch Klicken auf Anzeigen wird die Lösung angezeigt!
Seite 9
|
|
S. 9, Aufgabe 2
Später wird eine genauere Begründung verlangt. An dieser Stelle genügt folgende Antwort: Aufgrund der gleichen Ladung und des gleichen Spins würden sich Elektronen zu stark abstoßen. Daher können sie sich nicht an der gleichen Stelle aufhalten.
|
Seite 11
S. 11, Aufgabe 3
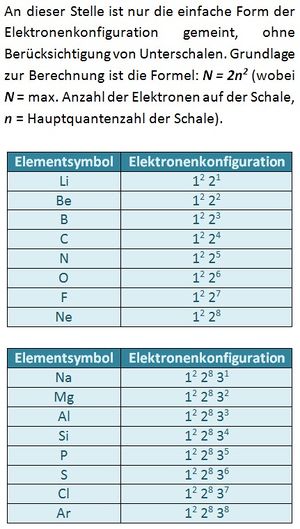
Es gibt immer drei p-Orbital, egal welche Schale. Da in jedem Orbital zwei Elektronen Platz finden können sich sowohl im 2p, als auch im 3p-Niveau maximal 6 Elektronen aufhalten. S. 11, Aufgabe 5
a) 2p7 ist unmöglich: Es existieren immer nur drei p-Orbitale. Darin finden maximal zwei Elektronen Platz. Das p-Niveau (egal welcher Schale) kann daher immer nur mit maximal 6 Elektronen besetzt sein. |
S. 11, Aufgabe 2
Normalerweise besetzen die Elektronen die energieärmsten Niveaus. Durch Energiezufuhr können jedoch auch Energieniveaus besetzt werden, die energetisch betrachtet höher liegen.
S. 11, Aufgabe 4
Der Grundzustand wäre: 1s2 2s2 2p6. Ein Elektron aus dem 2p-Niveau befindet sich jedoch auf dem nächst höheren Niveau: 3s.
|
Seite 13
S. 11, Aufgabe 1
Durch die Hauptquantenzahl n,
|
S. 13, Aufgabe 2
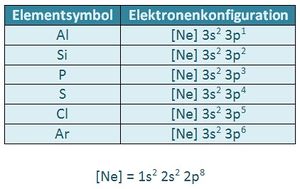
An einem unbeeinflussten Atom sind die drei p-Orbitale (px, py und pz) als energetisch gleichwertig zu betrachten.
|
Laptop-Aufgaben
Lösungen zu den Aufgaben
Durch Klicken auf Anzeigen wird die Lösung angezeigt!
Buch, S. 112 Aufgabe 4
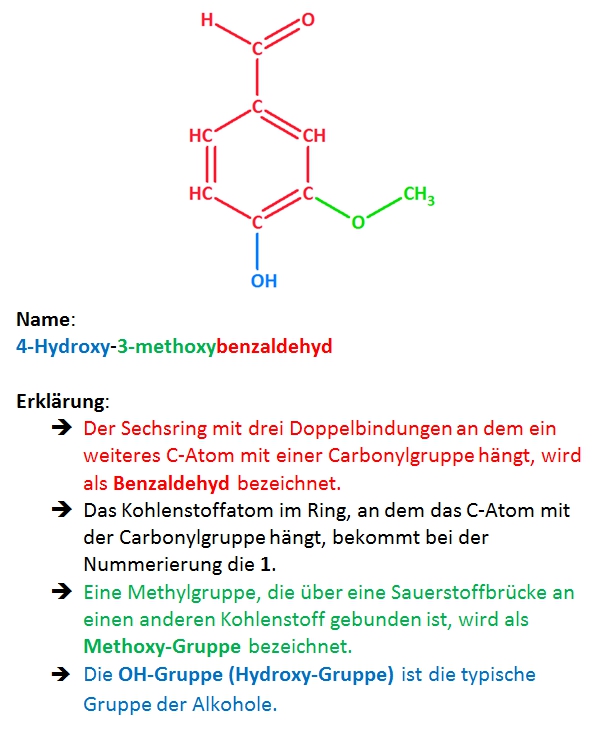
1. Zeichne die Strukturformel von Vanillin in ChemSketch und gib den systematischen Namen an!
Strukturformel von Vanillin:
Erklärungen zur Namensgebung:
Laptopstunde Nr. 4
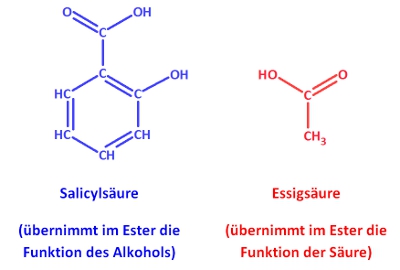
Acetylsalicylsäure (ASS) ist Bestandteil des bekanntesten Medikaments der Welt: Aspirin.
a) Recherchiere die Valenzstrichformel!
b) Bei ASS handelt es sich um einen Ester! Durch Hydrolyse kann man diesen Ester spalten. Zeichne in ChemSketch die beiden entstehenden Produkte und lasse sie benennen!
c) Gib auch an, unter welchen Reaktionsbedingungen man die Esterhydrolyse durchführen kann!
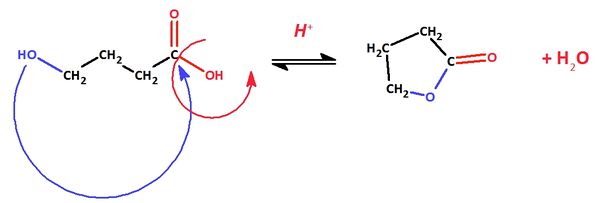
Ein Ester entsteht durch die Reaktion einer Hydroxgruppe mit einer Carboxygruppe. Befindet sich an einer C-Kette sowohl eine Hydroxygruppe als auch eine Carboxygruppe, kommt es zu einem intramolekularen Ringschluss (das Molekül reagiert mit sich selbst). Die entstehenden intramolekularen Ester nennt man Lactone.
a) Formuliere die Reaktion von 4-Hydroxybutansäure zu einem Lacton mit Valenzstrichformeln in ChemSketch!
b) Im Wikipedia-Artikel „Lactone“ sind im Bild rechts oben jeweils die einfachsten  -,
-, 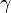 -,
-, 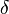 -,
-,  -Lactone dargestellt.
-Lactone dargestellt.
ba) Erkläre die Bedeutung der griechischen Buchstabens!
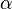 -Hydroxycarbonsäure (diese können keine intramolekularen Ester bilden!). Hängt die Hydroxgruppe an einem C-Atom, das zwei C-Atome vom Carboxy-C-Atom entfernt ist, spricht von
-Hydroxycarbonsäure (diese können keine intramolekularen Ester bilden!). Hängt die Hydroxgruppe an einem C-Atom, das zwei C-Atome vom Carboxy-C-Atom entfernt ist, spricht von 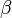 -Hydroxycarbonsäuren (diese bilden
-Hydroxycarbonsäuren (diese bilden 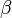 -Lactone) usw.
-Lactone) usw. Veranschaulichung:
bb) Zeichne von allen abgebildeten Lactonen das geöffnete Molekül (die „Hydroxy-Carbonsäuren“) und benenne sie systematisch!
Zwei Milchsäuremoleküle können nach folgendem Mechanismus zu einem sogenannte Lactid reagieren:
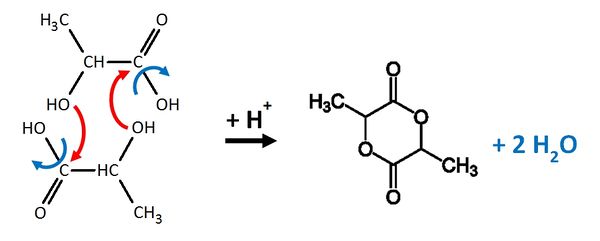
a) Recherchiere die Valenzstrichformel für Mandelsäure!
b) Stelle die Bildung des Mandelsäure-Lactids genau so dar, wie oben die Reaktion zweier Milchsäuremoleküle zum Lactid!