10a 2011 12: Unterschied zwischen den Versionen
Aus RMG-Wiki
| Zeile 132: | Zeile 132: | ||
<div style="margin:0; border:2px solid #00008B; padding: 0em 1em 1em 1em; background-color:#F5F5F5; align:left;"> | <div style="margin:0; border:2px solid #00008B; padding: 0em 1em 1em 1em; background-color:#F5F5F5; align:left;"> | ||
| − | ==Grundwissen== | + | ==Grundwissen Anorganische Chemie== |
''Folgende Begriffe solltest Du erklären können:'' | ''Folgende Begriffe solltest Du erklären können:'' | ||
| Zeile 158: | Zeile 158: | ||
=== <span style="color:#7D26CD;"> Säuren und ihre Anionen </span> === | === <span style="color:#7D26CD;"> Säuren und ihre Anionen </span> === | ||
| − | < | + | |
| + | '''Säuren''' sind Stoffe, die Protonen (H<sup>+</sup>-Ionen) abgeben können. <br> | ||
| + | '''Basen''' sind Stoffe, die Protonen aufnehmen können. <br> | ||
| + | '''Ampholyte''' können sowohl Protonen aufnehmen, als auch abgeben <br> | ||
| + | <br> | ||
| + | Beispiel: Hydrogenchlorid wird in Wasser geleitet <br> | ||
| + | HCl + H<sub>2</sub>O <math>\rightarrow</math> Cl<sup>-</sup> + H<sub>3</sub>O<sup>+</sup> <br> | ||
| + | |||
| + | Beispiel: Ammoniak wird in Wasser geleitet <br> | ||
| + | NH<sub>3</sub> + H<sub>2</sub>O <math>\rightarrow</math> NH<sub>4</sub><sup>+</sup> + OH<sup>-</sup> <br> | ||
| + | |||
* '''Schwefelsäure (H<sub>2</sub>SO<sub>4</sub>)''': HSO<sub>4</sub><sup>-</sup> '''Hydrogensulfat''', SO<sub>4</sub><sup>2-</sup> '''Sulfat''' | * '''Schwefelsäure (H<sub>2</sub>SO<sub>4</sub>)''': HSO<sub>4</sub><sup>-</sup> '''Hydrogensulfat''', SO<sub>4</sub><sup>2-</sup> '''Sulfat''' | ||
* '''Kohlensäure (H<sub>2</sub>CO<sub>3</sub>)''': HCO<sub>3</sub><sup>-</sup> '''Hydrogencarbonat''', CO<sub>3</sub><sup>2-</sup> '''Carbonat''' | * '''Kohlensäure (H<sub>2</sub>CO<sub>3</sub>)''': HCO<sub>3</sub><sup>-</sup> '''Hydrogencarbonat''', CO<sub>3</sub><sup>2-</sup> '''Carbonat''' | ||
* '''Phosphorsäure (H<sub>3</sub>PO<sub>4</sub>)''': H<sub>2</sub>PO<sub>4</sub><sup>-</sup> '''Dihydrogenphosphat''', HPO<sub>4</sub><sup>2-</sup> '''Hydrogenphosphat''', PO<sub>4</sub><sup>3-</sup> '''Phosphat''' | * '''Phosphorsäure (H<sub>3</sub>PO<sub>4</sub>)''': H<sub>2</sub>PO<sub>4</sub><sup>-</sup> '''Dihydrogenphosphat''', HPO<sub>4</sub><sup>2-</sup> '''Hydrogenphosphat''', PO<sub>4</sub><sup>3-</sup> '''Phosphat''' | ||
* '''Salpetersäure (HNO<sub>3</sub>)''': NO<sub>3</sub><sup>-</sup> '''Nitrat''' </span> | * '''Salpetersäure (HNO<sub>3</sub>)''': NO<sub>3</sub><sup>-</sup> '''Nitrat''' </span> | ||
| + | |||
| + | === <span style="color:#0000FF;"> Oxidation und Reduktion </span> === | ||
| + | |||
| + | * ''hier fehlt noch etwas!'' | ||
| + | ==Grundwissen Organische Chemie== | ||
| + | * ''hier fehlt noch etwas!'' | ||
</div> | </div> | ||
Version vom 15. April 2012, 20:27 Uhr
Mathematik 10
Biologie
Zum Unterricht
Referate
|
Externe links
Präsentationstechnik
|
Chemie
Termine1. Kurzarbeit: 29.11.2011 - vorbei - 2. Kurzarbeit: - noch nicht festgelegt -
|
Externe links- keine links - |
Versuchsprotokolle zu den Übungennoch keine Versuchsprotokolle |
Lösungen zu Aufgaben
|
|
|
Grundwissen Anorganische Chemie
Folgende Begriffe solltest Du erklären können:
Gemische
- homogene: Legierung, Lösung, Gasgemisch
- heterogene: Feststoffgemisch, Emulsion, Suspension, Nebel, Schaum, Rauch
- Trennverfahren: Filtration, Destillation, Chromatographie
Aggregatszustände
- Zustände: fest (s), flüssig (l), gasförmig (g)
- Zustandsänderungen: schmelzen - erstarren, verdampfen - kondensieren, sublimieren - resublimieren
Einteilung chemischer Reaktionen
- nach der Energieänderung: exotherm, endotherm, Aktivierungsenergie, freiwerdende Energie, aufzuwendende Energie, Katalysator
- nach der Umgruppierung der Teilchen: Synthese, Analyse, Umsetzung
Aufstellen chemischer Gleichungen
- Begriffe: Elementsymbol, chemische Formel, Reaktionspfeil, Index, Koeffizient
- molekular formulierte Elemente: Wasserstoff (H2), Stickstoff (N2), Sauerstoff (O2), Fluor (F2), Chlor (Cl2), Brom (Br2), Iod (I2)
Säuren und ihre Anionen
Säuren sind Stoffe, die Protonen (H+-Ionen) abgeben können.
Basen sind Stoffe, die Protonen aufnehmen können.
Ampholyte können sowohl Protonen aufnehmen, als auch abgeben
Beispiel: Hydrogenchlorid wird in Wasser geleitet
HCl + H2O 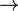 Cl- + H3O+
Cl- + H3O+
Beispiel: Ammoniak wird in Wasser geleitet
NH3 + H2O 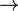 NH4+ + OH-
NH4+ + OH-
- Schwefelsäure (H2SO4): HSO4- Hydrogensulfat, SO42- Sulfat
- Kohlensäure (H2CO3): HCO3- Hydrogencarbonat, CO32- Carbonat
- Phosphorsäure (H3PO4): H2PO4- Dihydrogenphosphat, HPO42- Hydrogenphosphat, PO43- Phosphat
- Salpetersäure (HNO3): NO3- Nitrat </span>
Oxidation und Reduktion
- hier fehlt noch etwas!
Grundwissen Organische Chemie
- hier fehlt noch etwas!

