10a 2011 12
Mathematik 10
Biologie
Zum Unterricht
Referate
|
Externe links
Präsentationstechnik
Organisatorisches zu den Referaten
|
Chemie
Termine1. Kurzarbeit: 29.11.2011 - vorbei - 2. Kurzarbeit: 15.06.2012 - vorbei -
|
Skript "Organische Chemie"
|
Versuchsprotokolle zu den Übungen
|
Lösungen zu Aufgaben
|
|
|
Grundwissen Anorganische Chemie
Folgende Begriffe solltest Du erklären können:
Gemische
- homogene: Legierung, Lösung, Gasgemisch
- heterogene: Feststoffgemisch, Emulsion, Suspension, Nebel, Schaum, Rauch
- Trennverfahren: Filtration, Destillation, Chromatographie
Aggregatszustände
- Zustände: fest (s), flüssig (l), gasförmig (g)
- Zustandsänderungen: schmelzen - erstarren, verdampfen - kondensieren, sublimieren - resublimieren
Einteilung chemischer Reaktionen
- nach der Energieänderung: exotherm, endotherm, Aktivierungsenergie, freiwerdende Energie, aufzuwendende Energie, Katalysator
- nach der Umgruppierung der Teilchen: Synthese, Analyse, Umsetzung
Aufstellen chemischer Gleichungen
- Begriffe: Elementsymbol, chemische Formel, Reaktionspfeil, Index, Koeffizient
- molekular formulierte Elemente: Wasserstoff (H2), Stickstoff (N2), Sauerstoff (O2), Fluor (F2), Chlor (Cl2), Brom (Br2), Iod (I2)
Säuren und ihre Anionen
Säuren sind Stoffe, die Protonen (H+-Ionen) abgeben können.
Basen sind Stoffe, die Protonen aufnehmen können.
Ampholyte können sowohl Protonen aufnehmen, als auch abgeben
Beispiel: Hydrogenchlorid wird in Wasser geleitet
HCl + H2O 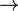 Cl- + H3O+
Cl- + H3O+
Beispiel: Ammoniak wird in Wasser geleitet
NH3 + H2O 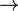 NH4+ + OH-
NH4+ + OH-
- Schwefelsäure (H2SO4): HSO4- Hydrogensulfat, SO42- Sulfat
- Kohlensäure (H2CO3): HCO3- Hydrogencarbonat, CO32- Carbonat
- Phosphorsäure (H3PO4): H2PO4- Dihydrogenphosphat, HPO42- Hydrogenphosphat, PO43- Phosphat
- Salpetersäure (HNO3): NO3- Nitrat </span>
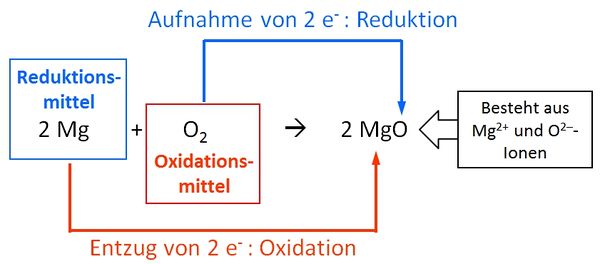
Oxidation und Reduktion
Oxidation: Entzug von Elektronen
Reduktion: Aufnahme von Elektronen
Oxidationsmittel: Ein Stoff der andere Stoffe oxidiert, ihnen also Elektronenen entreißt, dabei selbst reduziert wird
Reduktionsmittel: Ein Stoff der andere Stoffe reduziert, ihnen also Elektronenen aufzwängt, dabei selbst oxidiert wird
Beispiel: Magnesium reagiert mit Sauerstoff:
Grundwissen Organische Chemie
- interner link: Grundwissen, 10. Klasse, organische Chemie
- interner link: Auf der folgenden verlinkten Seite sind Regeln und Übungen zum Benennen von organischen Verbindungen (mit verzweigten Seitenketten) enthalten. Allerdings zählt das nicht zum Grundwissen, die Aufgaben sind teilweise wirklich schwierig! Chemie: Benennung organischer Verbindungen

