W-Seminar Chemie 2011 2013 - Komplexe in der Chemie
Organisatorisches
Termine kommender Freitag, 16.12.: Festlegung der Arbeitsthemen
|
Was im Moment zu tun istHausaufgabe:
|
Schriftliches
Hefteinträge1. Der Aufbau einer wissenschaftlichen Arbeit
2. Fachlicher Hintergrund Neu, 21.10.2011:
|
Externe Links
|
Teilnehmer
EisJan
GebSim
HöcKil
HücPhi
KaiFab
MülFel
|
MülPhi
RügMar
SchFab
WicAnn
WunJul
|
Lösungen zu den Aufgaben
Durch Klicken auf Anzeigen wird die Lösung angezeigt!
Ihr solltet wirklich erst auf Anzeigen klicken, wenn ihr die Aufgabe gelöst habt! - Alles andere erzeugt keinerlei Lerneffekt!
Lösungen (S. 9 - 17)S. 9
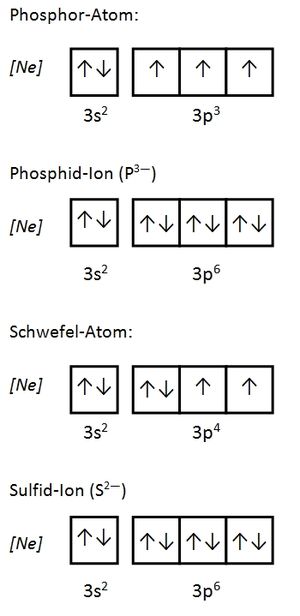
Später wird eine genauere Begründung verlangt. An dieser Stelle genügt folgende Antwort: Aufgrund der gleichen Ladung und des gleichen Spins würden sich Elektronen zu stark abstoßen. Daher können sie sich nicht an der gleichen Stelle aufhalten. S. 11
Normalerweise besetzen die Elektronen die energieärmsten Niveaus. Durch Energiezufuhr können jedoch auch Energieniveaus besetzt werden, die energetisch betrachtet höher liegen.
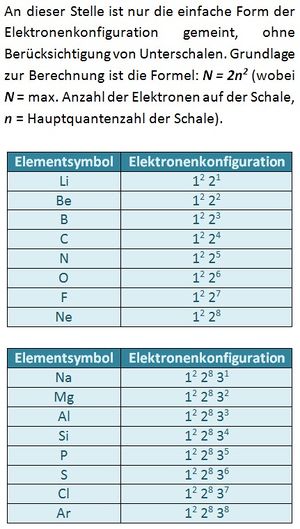
Es gibt immer drei p-Orbital, egal welche Schale (außer der ersten, K-Schale. Diese besteht nur aus einem s-Orbital). Da in jedem Orbital zwei Elektronen Platz finden können sich sowohl im 2p, als auch im 3p-Niveau maximal 6 Elektronen aufhalten.
Der Grundzustand wäre: 1s2 2s2 2p6. Ein Elektron aus dem 2p-Niveau befindet sich jedoch auf dem nächst höheren Niveau: 3s.
a) 2p7 ist unmöglich: Es existieren immer nur drei p-Orbitale. In jedem finden maximal zwei Elektronen Platz. Das p-Niveau (egal welcher Schale) kann daher immer nur mit maximal 6 Elektronen besetzt sein. S. 13
Durch die Hauptquantenzahl n,
An einem unbeeinflussten Atom sind die drei p-Orbitale (px, py und pz) als energetisch gleichwertig zu betrachten.
Seite 15
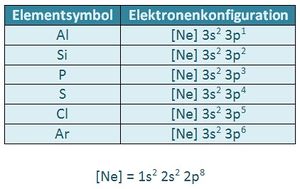
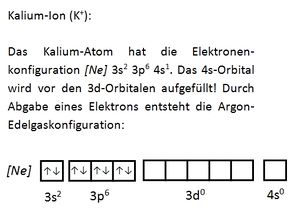
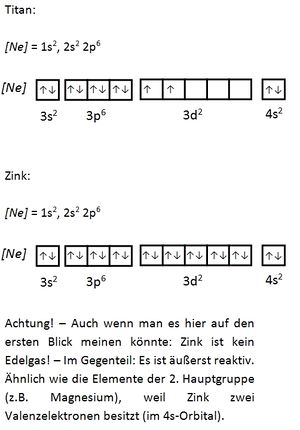
Innerhalb einer Periode werden die mit steigender Ordnungszahl neu hinzukommenden Elektronen auf der gleichen Schale eingebaut. Dies gilt allerdings nur für die Hauptgruppen. Bei den Nebengruppenelementen werden nachträglich die d-Orbitale der vorangegangenen Schale aufgefüllt. (Die f-Orbitale werden noch später aufgefüllt.)
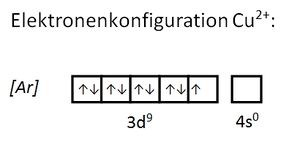
Valenzelektronen sind die Elektronen, die sich auf den energetisch höchsten (äußersten) Unterschalenniveaus (Orbitalen) befinden und für Bindungen herangezogen werden können. Bei den Hauptgruppenelementen sind dies die Elektronen der s- und p-Orbitale, bei den Übergangsmetallen zusätzlich die d-Orbitale. Durch die Abgabe der Valenzelektronen wird eine Edelgaskonfiguration erreicht. Der Atomrumpf ist der Rest. Seite 17
s. Hefteintrag!
|
Lösungen (S. 32 - 45)Seite 33
Seite 35
Seite 37
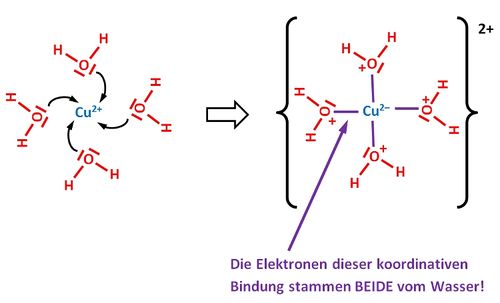
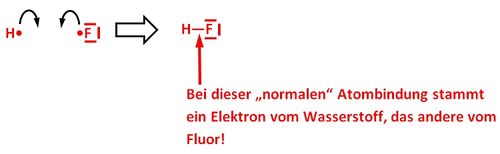
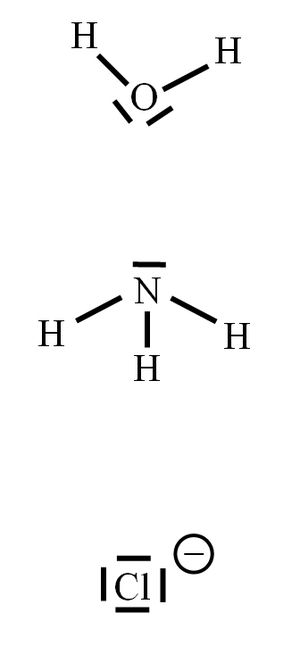
Unter einer koordinativen Bindung versteht man eine Bindung, die durch gemeinsame Nutzung von Elektronpaaren zustande kommt. Im Vergleich zu einer „normalen“ Atombindung wird allerdings das bindende Elektronenpaar komplett von einem Partner (dem Liganden) zur Verfügung gestellt. Seite 38
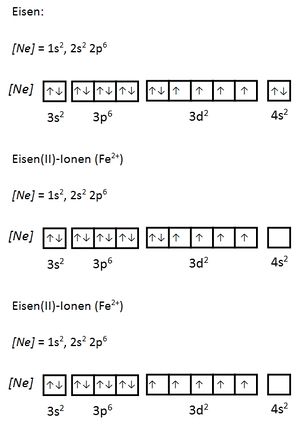
Im Fe3+-Komplex ist das Zentralion stärker geladen als im Fe2+-Komplex, daher „zieht“ es stärker am bindenden Elektronepaar. Daher lockert sich auch die Bindung des Sauerstoffs zum Wasserstoff und dieses kann leichter als Proton abgespalten werden. Da die Fähigkeit Proton abzuspalten als Maß für die Stärke einer Säure angesehen werden kann, ist der Fe3+-Komplex saurer als der Fe2+-Komplex.
Seite 41
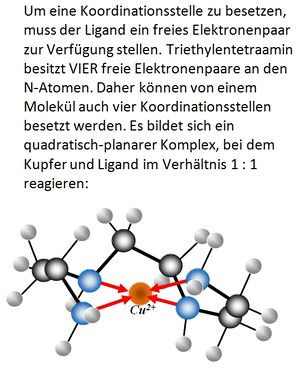
Die Aussage würde nur für EINZÄHNIGE Liganden (wie Wasser oder Ammoniak) gelten. MEHRZÄHNIGE LIGANDEN können mehrere Koordinationsstellen besetzen, der Stoff EDTA z.B. SECHS.
[Co(ox)3]3—
Kohlenstoffmonooxid wirkt als Ligand und kann koordinativ an das Eisenatom in der Hämgruppe des Hämo- bzw. Myoglobins binden. An dieser Stelle wird normalerweise Sauerstoff gebunden und durch den Körper transportiert. Ist die Koordinationsstelle jedoch mit CO besetzt, erfolgt kein Sauerstofftransport mehr, der Körper erstickt. Seite 43
Ursache für die Eutrophierung sind Phosphate bzw. Stickstoffverbindungen, die durch Düngung oder Waschmittel in die Seen gelangen. Diese Stoffe wirken als Dünger für Pflanzen und führen zu explosionsartigem Wachstum von Algen. Die großen Mengen an organischem Material werden von den Destruenten im See unter Sauerstoffverbrauch zersetzt. Der Sauerstoff steht dann z.B. den Fischen nicht mehr zur Verfügung. Reicht der vorhandene Sauerstoff für die Zersetzung nicht, bauen die Destruenten anaerob ab und erzeugen dabei giftige Faulgase. Dadurch „kippt der See um“. Seite 45
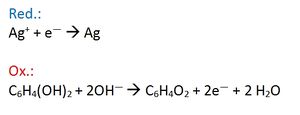
Würde man lange genug warten, würde das gesamte Bild geschwärzt werden (d.h. das gesamte Silbersalz zu schwarzem Silber reduziert werden)! Allerdings beginnt die Reduktion an den Silberkeimen, die durch die Belichtung entstanden sind. Wenn man den Prozess durch Wässern rechtzeitig unterbricht, sind nur an den belichteten Stellen große, sichtbare (schwarze) Silberkristalle entstanden.
|
Fragen zu den Aufgaben - per e-mail gestellt
Als Lösung für die Aufgabe 1 auf seite 37! haben sie als antwort: Unter einer koordinativen Bindung versteht man eine Bindung, die durch gemeinsame Nutzung von Elektronpaaren zustande kommt. Im Vergleich zu einer „normalen“ Atombindung wird allerdings das bindende Elektronenpaar komplett von einem Partner (dem Liganden) zur Verfügung gestellt.
Ist das nicht genau umgekehrt?
Nein! Es ist genau so! Vielleicht sind die folgenden Bilder etwas aufschlussreicher. Bei dem (fiktiven) Komplex [Cu(H2O)4]2+ stammen bei jeder koordinativen Bindung BEIDE ELEKTRONEN VOM LIGANDEN (H2O). Bei einer "normalen" Atombindung, z.B. im HF (Hydrogenfluorid) würde jedes Atom ein Elektron zur Atombindung beisteuern.