10a 2011 12
Aus RMG-Wiki
Version vom 25. Mai 2012, 16:37 Uhr von Thomas Lux (Diskussion | Beiträge)
Mathematik 10
Biologie
Zum Unterricht
Referate
|
Externe links
Präsentationstechnik
Organisatorisches zu den Referaten
|
Chemie
Termine1. Kurzarbeit: 29.11.2011 - vorbei - 2. Kurzarbeit: 15.06.2012
|
Externe links- keine links - |
Versuchsprotokolle zu den Übungen
|
Lösungen zu Aufgaben
|
|
|
Grundwissen Anorganische Chemie
Folgende Begriffe solltest Du erklären können:
Gemische
- homogene: Legierung, Lösung, Gasgemisch
- heterogene: Feststoffgemisch, Emulsion, Suspension, Nebel, Schaum, Rauch
- Trennverfahren: Filtration, Destillation, Chromatographie
Aggregatszustände
- Zustände: fest (s), flüssig (l), gasförmig (g)
- Zustandsänderungen: schmelzen - erstarren, verdampfen - kondensieren, sublimieren - resublimieren
Einteilung chemischer Reaktionen
- nach der Energieänderung: exotherm, endotherm, Aktivierungsenergie, freiwerdende Energie, aufzuwendende Energie, Katalysator
- nach der Umgruppierung der Teilchen: Synthese, Analyse, Umsetzung
Aufstellen chemischer Gleichungen
- Begriffe: Elementsymbol, chemische Formel, Reaktionspfeil, Index, Koeffizient
- molekular formulierte Elemente: Wasserstoff (H2), Stickstoff (N2), Sauerstoff (O2), Fluor (F2), Chlor (Cl2), Brom (Br2), Iod (I2)
Säuren und ihre Anionen
Säuren sind Stoffe, die Protonen (H+-Ionen) abgeben können.
Basen sind Stoffe, die Protonen aufnehmen können.
Ampholyte können sowohl Protonen aufnehmen, als auch abgeben
Beispiel: Hydrogenchlorid wird in Wasser geleitet
HCl + H2O 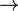 Cl- + H3O+
Cl- + H3O+
Beispiel: Ammoniak wird in Wasser geleitet
NH3 + H2O 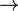 NH4+ + OH-
NH4+ + OH-
- Schwefelsäure (H2SO4): HSO4- Hydrogensulfat, SO42- Sulfat
- Kohlensäure (H2CO3): HCO3- Hydrogencarbonat, CO32- Carbonat
- Phosphorsäure (H3PO4): H2PO4- Dihydrogenphosphat, HPO42- Hydrogenphosphat, PO43- Phosphat
- Salpetersäure (HNO3): NO3- Nitrat </span>
Oxidation und Reduktion
- hier fehlt noch etwas!
Grundwissen Organische Chemie
- hier fehlt noch etwas!

