W-Seminar Chemie 2011 2013 - Komplexe in der Chemie
Organisatorisches
Termine
|
Externe Links
|
Schriftliches
Hefteinträge1. Der Aufbau einer wissenschaftlichen Arbeit
2. Fachlicher Hintergrund Neu, 21.10.2011: Hefteintrag folgt!
|
Was im Moment zu tun istDie ausgeteilten Buchseiten (S. 32 – 39) sollten bis zum nächsten Treffen (11.11.11) von allen gelesen sein. Diejenigen, die an diesem Tag ein Referat halten, müssen den folgenden Terminplan etwas schneller abarbeiten!
|
Teilnehmer
0oo0oo
|
EisJanFr., 11.11.: Referat, S. 32 - 33 Versuche für Referat ausprobieren: Di, 25.10. 13:05 Uhr, Chemie-Sammlung |
GebSimFr., 18.11.: Referat, S. 42 - 43
|
HöcKilFr., 18.11.: Referat, S. 44 - 45 |
HücPhiFr., 11.11.: Referat, S. 38 - 39
|
KaiFab |
MülFel
|
MülPhiFr., 18.11.: Referat, S. 40 - 41 |
RügMarFr., 11.11.: Referat, S. 34 - 35
|
SchFabFr., 11.11.: Referat, S. 36 - 37 |
WicAnn
|
WunJul |
Lösungen zu den Aufgaben
Durch Klicken auf Anzeigen wird die Lösung angezeigt!
Ihr solltet wirklich erst auf Anzeigen klicken, wenn ihr die Aufgabe gelöst habt! - Alles andere erzeugt keinerlei Lerneffekt!
Lösungen zu den Aufgaben (Bau der Elektronenhülle)S. 9
Später wird eine genauere Begründung verlangt. An dieser Stelle genügt folgende Antwort: Aufgrund der gleichen Ladung und des gleichen Spins würden sich Elektronen zu stark abstoßen. Daher können sie sich nicht an der gleichen Stelle aufhalten. S. 11
Normalerweise besetzen die Elektronen die energieärmsten Niveaus. Durch Energiezufuhr können jedoch auch Energieniveaus besetzt werden, die energetisch betrachtet höher liegen.
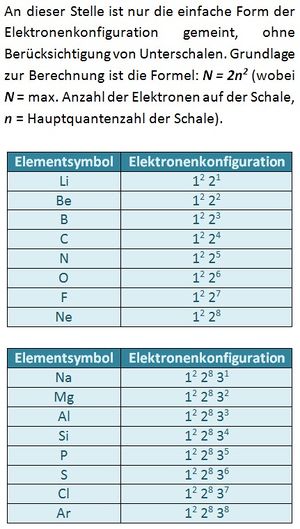
Es gibt immer drei p-Orbital, egal welche Schale (außer der ersten, K-Schale. Diese besteht nur aus einem s-Orbital). Da in jedem Orbital zwei Elektronen Platz finden können sich sowohl im 2p, als auch im 3p-Niveau maximal 6 Elektronen aufhalten.
Der Grundzustand wäre: 1s2 2s2 2p6. Ein Elektron aus dem 2p-Niveau befindet sich jedoch auf dem nächst höheren Niveau: 3s.
a) 2p7 ist unmöglich: Es existieren immer nur drei p-Orbitale. In jedem finden maximal zwei Elektronen Platz. Das p-Niveau (egal welcher Schale) kann daher immer nur mit maximal 6 Elektronen besetzt sein. S. 13
Durch die Hauptquantenzahl n,
An einem unbeeinflussten Atom sind die drei p-Orbitale (px, py und pz) als energetisch gleichwertig zu betrachten.
Seite 15
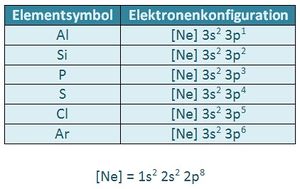
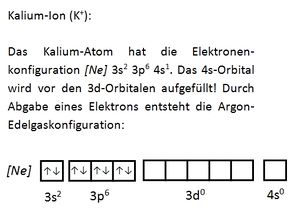
Innerhalb einer Periode werden die mit steigender Ordnungszahl neu hinzukommenden Elektronen auf der gleichen Schale eingebaut. Dies gilt allerdings nur für die Hauptgruppen. Bei den Nebengruppenelementen werden nachträglich die d-Orbitale der vorangegangenen Schale aufgefüllt. (Die f-Orbitale werden noch später aufgefüllt.)
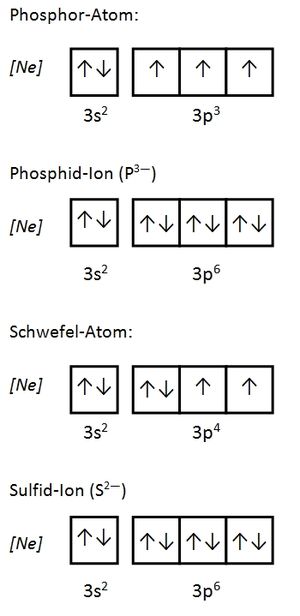
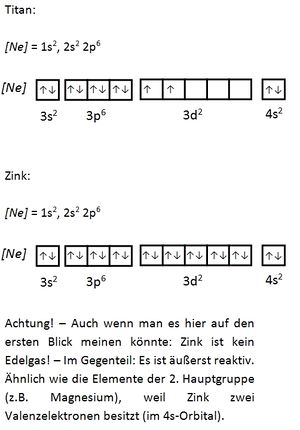
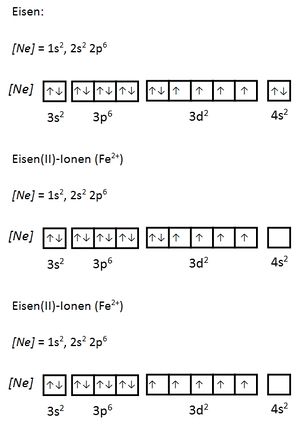
Valenzelektronen sind die Elektronen, die sich auf den energetisch höchsten (äußersten) Unterschalenniveaus (Orbitalen) befinden und für Bindungen herangezogen werden können. Bei den Hauptgruppenelementen sind dies die Elektronen der s- und p-Orbitale, bei den Übergangsmetallen zusätzlich die d-Orbitale. Durch die Abgabe der Valenzelektronen wird eine Edelgaskonfiguration erreicht. Der Atomrumpf ist der Rest. Seite 17
s. Hefteintrag!
|
Lösungen zu den Aufgaben (Komplexe)Seite 33Seite 35Seite 37Seite 38Seite 41Seite 43
|