|
|
| Zeile 450: |
Zeile 450: |
| | <br><br> | | <br><br> |
| | </td></tr></table></center> | | </td></tr></table></center> |
| | + | |
| | + | |
| | + | [[Kategorie:RMG2Edutags]] |
| | + | <metakeywords>RMG2Edutags,RMG-Wiki,ZUM.de,OER,Grundwissen Chemie: 8. Klasse NTG,Grundwissen,Chemie,8. Klasse</metakeywords> |
Version vom 15. Oktober 2014, 23:25 Uhr
Diese Seite ist noch in Bearbeitung!
- Stoffe
Gemische
Man unterscheidet homogenen Gemische:
Legierung
Lösung
Gasgemisch
und heterogene Gemische:
Feststoffgemisch
Emulsion
Suspension
Nebel
Schaum
Rauch
Wichtige Trennverfahren:
Filtration
Destillation
Chromatographie
|
|
Quiz zum Thema
Klicke im unteren violetten Kasten auf die grünen Begriffe und ziehe sie in den passenden grauen Kasten, der den Überbegriff enthält!
Suspension Emulsion Legierung Lösung Reinstoff (kein Gemisch) EisenHefeweizenMayonnaiseSchwefelBronzeWeinMineralwasserMessingSonnencremeBlut
|
Weiteres Quiz zum Thema
Ordne die Puzzle-Teile so an, dass eine funktionionstüchtige Destillationsapparatur entsteht!
Ordne anschließend den Nummern den richtigen Fachbegriff zu!
Durch Klicken auf Anzeigen wird die Lösung angezeigt!
[Anzeigen][Verstecken]
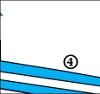
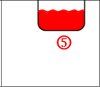
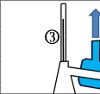
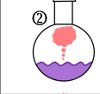
Lösung: (1) Bunsenbrenner, (2) Rundkolben, (3) Thermometer, (4) Kühler, (5) Destillat
links zum Thema:
Animation auf Teilchenebene zur Chromatographie eines Filzstiftstriches:
http://www.chemie-interaktiv.net/html_flash/ff_chromatographie_filzstift.swf
|
Reinstoffe
Man unterscheidet Verbindungen:
Salze
Moleküle
und Elemente:
Metalle (im PSE eher links unten)
Halbmetalle
Nichtmetalle (im PSE eher rechts oben)
|
|
Quiz zum Thema
Klicke im unteren violetten Kasten auf die grünen Begriffe und ziehe sie in den passenden Platzhalter im Text!
Nichtmetalle müssen zum Erreichen einer Edelgaskonfiguration Elektronen . In Salzen bilden Sie daher geladene . Mit anderen Nichtmetallen bilden sie aus. Abgesehen von den Edelgasen werden gasförmige Nichtmetalle daher (z.B. O2) formuliert.
Metalle müssen zum Erreichen einer Edelgaskonfiguration Elektronen . In Salzen bilden Sie daher geladene .
AnionenpositivabgebenmolekularnegativaufnehmenKationenAtombindungen
|
links zum Thema:
- keine
|
Stoffeigenschaften
Neben typischen Kenngrößen, wie:
Dichte
Siedetemperatur
Schmelztemperatur
entscheiden oft folgende Eigenschaften über den Einsatz eines Stoffes:
Härte
Leitfähigkeit (Wärme, Elektrizität)
Farbe, Geruch, Geschmack
Löslichkeit
Kristallform
|
|
Quiz zum Thema
Finde heraus, um welches Element es sich handelt!
|
links zum Thema:
- keine
|
- Atome
Eine einfache Modellvorstellung
Am Aufbau von Atomen beteiligte Teilchen
Im Kern:
- Protonen (Masse: ca. 1u, Ladung: +1)
- Neutronen (Masse: ca. 1u, Ladung: 0)
In der Hülle:
- Elektronen ( Masse: ca. 0u, Ladung: -1)
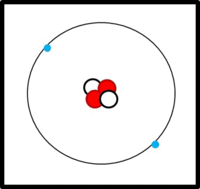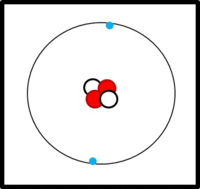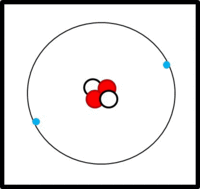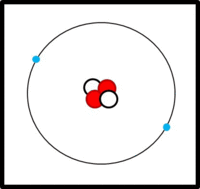
Der Aufbau von Elementen lässt sich mit Hilfe der Daten im PSE ableiten:
Die Ordnungs- / Kernladungszahl gibt die Zahl der Protonen an. Bei ungeladenen Atomen müssen sich in der Hülle genausoviele Elektronen befinden.
Die Massenzahl gibt die Anzahl der Kernteilchen (Protonen + Neutronen) an.

Die Elektronen befinden sich auf verschiedenen Schalen. Die Schalen werden von innen nach außen mit den Hauptquantenzahlen n = 1, 2, 3,... oder mit Großbuchstaben K, L, M,... charakterisiert. Bei der Besetzung der Schalen mit Elektronen werden die innersten Schalen zuerst besetzt. Auf einer Schale haben 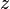 Elektronen Platz, wobei gilt: Elektronen Platz, wobei gilt: 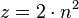 . .
Diese Regeln sind stark vereinfacht und können nur für die Elemente der ersten 3 Perioden angewendet werden!
Bsp.: Bau der Elektronenhülle von 11Na
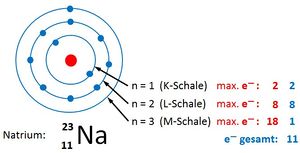
|
|
Quiz zum Thema
Lithium enthält Protonen, Neutronen und insgesamt Elektronen. Davon befindet /befinden sich auf der L-Schale.
Chlor enthält Protonen, Neutronen und insgesamt Elektronen. Davon befindet /befinden sich auf der L-Schale und auf der M-Schale.
181748371731
Ordne den Beschreibungen das richtige Element zu!
Im ungeladenen Zustand besitzt dieses Atom 32 Elektronen:
Dieses Element hat eine einstellige, gerade Anzahl an Protonen und eine ungerade Anzahl an Neutronen:
Das erste Element im PSE mit einer Massenzahl größer als 100:
Gibt dieses Element ein Elektron ab, besitzt es genausoviele wie Helium:
Nimmt dieses Element ein weiteres Elektron auf, besitzt es genausoviele wie Krypton:
BerylliumLithiumBromRutheniumGermanium
|
links zum Thema:
keine
|
- Stoffklassen und Bindungstypen
Salze / Ionenbindung
Bei der Reaktion von Metallen mit Nichtmetallen entstehen Salze: Das Metall gibt Elektronen ab, das Nichtmetall nimmt Elektronen auf. Die Ionen besitzen dann i.d.R. Edelgaskonfiguration. Es entstehen riesige, aus sehr vielen Ionen aufgebaute, regelmäßige Strukturen: Die Salzkristalle.
Wichtige Eigenschaften von Salzen:
- hohe Schmelz- und Siedepunkte
- spröde
- oft löslich in Wasser
Beispiel:
Lithiumatome geben ein Elektron ab, Fluoratome nehmen ein Elektron auf. Es entstehen viele Ionen, die sich in einem regelmäßigen Gitter anordnen:
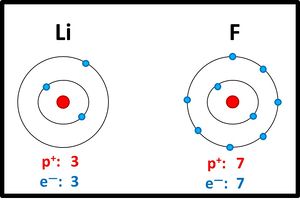
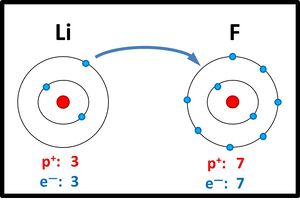
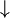
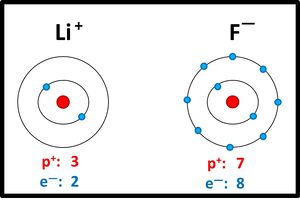
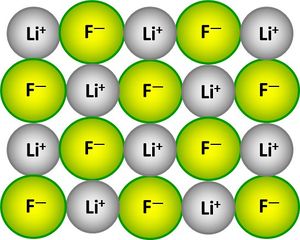
2dimensionales Kristallgitter von LiF
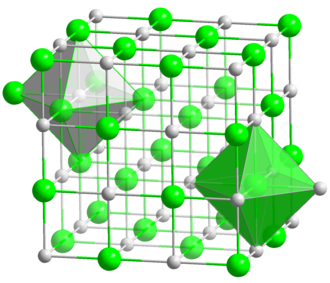
3dimensionales Kristallgitter von LiF
|
|
Quiz zum Thema
Bei Hauptgruppenelementen ist leicht zu erkennen, wie viele Elektronen abgegeben, bzw. aufgenommen werden. In der chemischen Formel eines Salzes müssen genau so viele Kationen und Anionen vorhanden sein, dass sich die positiven und negativen Ladungen aufheben,
Bsp.:
Aus Aluminium und Sauerstoff bildet sich Al2O3
Aluminium gibt 3e- ab: Al  Al3+ +3e- Al3+ +3e-
Sauerstoff nimmt 2e- auf: O + 2e-  O2- O2-
Ein neutrales Salz entsteht durch die Kombination:
Al2O3
2 x Al3+ = Ladung: +6
3 x O2- = Ladung: -6
Wichtig: Gase müssen in der Gleichung immer molekular (X2) formuliert werden!
Gesamtgleichung:
4 Al + 3 O2  2 Al2O3 2 Al2O3
Formuliere die chemische Gleichung zu folgenden Reaktionen!
|
links zum Thema:
Animation eines Salzkristalls, der sich in Wasser auflöst:
kurz: http://www.chemie-interaktiv.net/html_flash/ff_loesung.swf
ausführlich: http://www.chemie-interaktiv.net/bilder/loesung_salz_wasser.swf
|
Moleküle / Atombindung
Nichtmetalle können sich mit anderen Nichtmetallen Elektronen "teilen". Die dabei entstehenden bindenden Elektronenpaare können beiden Atomkernen zugeordnet werden. Auf diese Weise wird zusammen mit den freien Elektronenpaaren oft für alle beteiligten Atome eine Edelgaskonfiguration erreicht.
Wichtige Eigenschaften von Molekülen:
- sehr vielfältig
- Schmelz- und Siedepunkte eher niedrig
- Löslichkeit sehr unterschiedlich
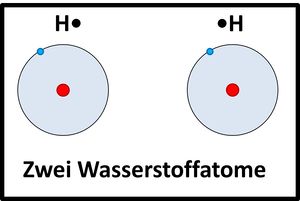
Beispiel:
Zwei Wasserstoffatome nähern sich aneinander an, die Elektronenhüllen überlappen sich und bilden einen neuen Aufenthaltsraum für Elektronen (Orbital), in dem sich beide Elektronen aufhalten und von beiden Atomkernen "benutzt" werden dürfen.
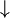
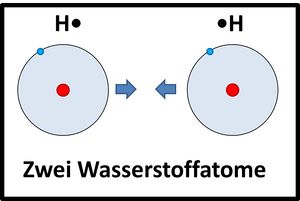
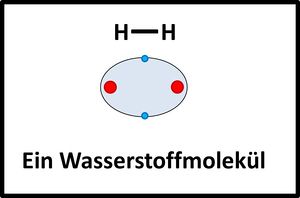
|
|
Quiz zum Thema
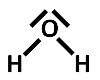
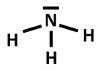
Zeichne die Valenzstrichformel der folgenden Moleküle!
|
links zum Thema:
keine
|
Metalle und Legierungen / Metallbindung
Bei der metallischen Bindung geben alle Metallatome im Verband oder in der Legierung ihre wenigen Valenzelektronen ab, die dann als frei bewegliches Elektronengas von allen verbleibenden positiv geladenen Atomrümpfen "benutzt" werden dürfen. Die Atomrümpfe ordnen sich in einer dichtesten Kugelpackung an.
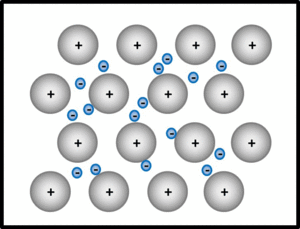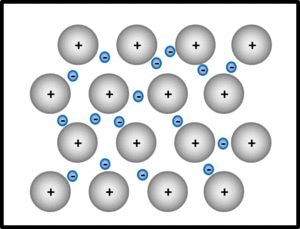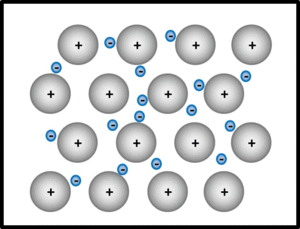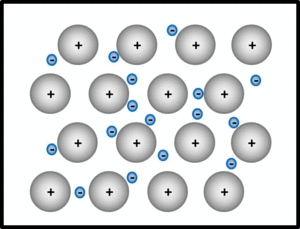
Wichtige Eigenschaften von Metallen:
- oft gut verformbar
- sehr gute Wärme- und elektrische Leiter
- nicht löslich
|
|
Quiz zum Thema
Klicke im unteren violetten Kasten auf die grünen Begriffe und ziehe sie in den passenden Platzhalter im Text!
Fast alle Metalle besitzen hohe Schmelz- und Siedpunkte. Nur ein einziges Metall ist bei Standardbedingungen flüssig: . Darüber hinaus gibt es zwei Metalle, deren Siedepunkte so niedrig sind, dass sie in der Hand schmelzen würden. Das eine ist jedoch hoch reaktiv und würde das Gewebe der Hand sofort zerstören: . Das andere wirkt zwar auch leicht ätzend auf der Haut, aber mutige Förscher können das schon mal aushalten: . (Ein Bild von diesem Versuch findet ihr mit der Google-Bilder-Suche, wenn ihr den Namen des Metalls und „Hand“ eingebt.)
Den höchsten Schmelzpunkt aller Metalle hat dagegen , weswegen es in Glühlampen als Glühfaden eingesetzt wurde: Sobald man das Licht anschaltete, floss ein hoher Strom durch den Wolframdraht, erhitzte ihn dabei sehr stark und brachte ihn zum Glühen. Aufgrund des hohen Schmelzpunktes blieb der Glühfaden jedoch fest.
Den höchsten Siedepunkt besitzt ein anderes Metall, welches z.B. als Katalysator für verschiedenste Reaktion verwendet wird: .
QuecksilberWolframRheniumGalliumCaesium
|
links zum Thema:
Veranschaulichung der Eigenschaften "Verformbarkeit" und "elektrische Leitfähigkeit" bei Metallen:
http://www.chemie-interaktiv.net/html_flash/ff_metallbindung.swf
|






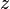 Elektronen Platz, wobei gilt:
Elektronen Platz, wobei gilt: 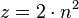 .
.

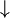




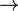 Al3+ +3e-
Al3+ +3e-