W-Seminar Chemie 2011 2013 - Komplexe in der Chemie: Unterschied zwischen den Versionen
| Zeile 17: | Zeile 17: | ||
==Termine== | ==Termine== | ||
| − | <span style="color:#ff0000;"> '' | + | * <span style="color:#ff0000;"> '''25.10.: 15:30 Uhr:''' Treffen im Lehrerzimmer für diejenigen, die mit zur Scheckübergabe beim Landrat gehen! </span> |
| + | * <span style="color:#ff0000;"> '''Am Freitag vor den Ferien (28.10.)''' entfällt das W-Seminar wegen der Fahrt nach Würzburg! </span><br> | ||
</div> | </div> | ||
| Zeile 68: | Zeile 69: | ||
'''2. Fachlicher Hintergrund''' | '''2. Fachlicher Hintergrund''' | ||
: '''2.1 Farben und Licht''' als [[media:WS1113_030.pdf|pdf-Datei]] | : '''2.1 Farben und Licht''' als [[media:WS1113_030.pdf|pdf-Datei]] | ||
| + | : '''2.2 Der Aufbau der Elektronenhülle''' als [[media:WS1113_040.pdf|pdf-Datei]] | ||
| − | <span style="color:#ff0000;"> '''Neu, | + | <span style="color:#ff0000;"> '''Neu, 21.10.2011:''' </span> |
| − | + | '''Hefteintrag folgt!''' | |
| − | + | ||
</div> | </div> | ||
| Zeile 86: | Zeile 87: | ||
== Was im Moment zu tun ist == | == Was im Moment zu tun ist == | ||
| − | + | Die ausgeteilten Buchseiten (S. 32 – 39) sollten bis zum nächsten Treffen (11.11.11) von allen gelesen sein. Diejenigen, die an diesem Tag ein Referat halten, müssen den folgenden Terminplan etwas schneller abarbeiten! <br> | |
| + | '''Vorschlag für einen Terminplan:'''<br> | ||
| + | * Mo, 24.10.: Seiten 32 – 33 | ||
| + | * Di, 25.10.: Aufgaben auf S. 33 lösen | ||
| + | * Mi, 26.10.: Seiten 34 – 35 | ||
| + | * Do, 27.10.: Aufgaben auf S. 35 lösen | ||
| + | * <span style="color:#0000FF;"> '''Ferien''' </span> | ||
| + | * Mo, 07.11.: Seiten 36 – 37 | ||
| + | * Di, 08.11.: Aufgabe auf S. 37 lösen | ||
| + | * Mi, 09.11.: Seiten 38 – 39 | ||
| + | * Do, 10.11.: Aufgaben auf S. 38 lösen | ||
| + | * <span style="color:#ff0000;"> '''Freitag, 11.11.: W-Seminar 5./6. Stunde (Referate S. 32 -39)''' </span> | ||
| + | * Mo, 14.11.: Seiten 40 – 41 | ||
| + | * Di, 15.11.: Aufgaben auf S. 41 lösen | ||
| + | * <span style="color:#0000FF;"> '''Mi, 16.11.: Feiertag (für Schüler)''' </span> | ||
| + | * Do, 16.11.: Seiten 42 – 43 | ||
| + | * <span style="color:#ff0000;">'''Freitag, 18.11.: W-Seminar 5./6. Stunde (Referate S. 40 – 45)'''</span> | ||
| + | |||
</div> | </div> | ||
Version vom 22. Oktober 2011, 09:31 Uhr
Organisatorisches
Termine
|
Externe Links
|
Schriftliches
Hefteinträge1. Der Aufbau einer wissenschaftlichen Arbeit
2. Fachlicher Hintergrund Neu, 21.10.2011: Hefteintrag folgt!
|
Was im Moment zu tun istDie ausgeteilten Buchseiten (S. 32 – 39) sollten bis zum nächsten Treffen (11.11.11) von allen gelesen sein. Diejenigen, die an diesem Tag ein Referat halten, müssen den folgenden Terminplan etwas schneller abarbeiten!
|
Teilnehmer
0oo0oo
|
EisJan |
GebSim
|
HöcKil |
HücPhi
|
KaiFab |
MülFel
|
MülPhi |
RügMar
|
SchFab |
WicAnn
|
WunJul |
Lösungen zu den Aufgaben
Durch Klicken auf Anzeigen wird die Lösung angezeigt!
Ihr solltet wirklich erst auf Anzeigen klicken, wenn ihr die Aufgabe gelöst habt! - Alles andere erzeugt keinerlei Lerneffekt!
Seite 9
|
|
S. 9, Aufgabe 2
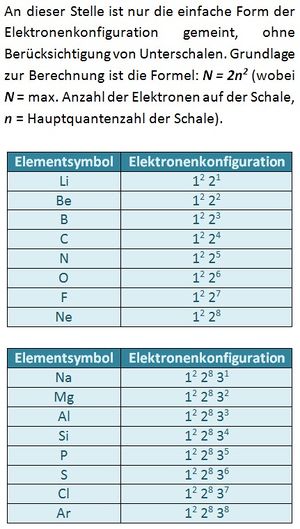
Später wird eine genauere Begründung verlangt. An dieser Stelle genügt folgende Antwort: Aufgrund der gleichen Ladung und des gleichen Spins würden sich Elektronen zu stark abstoßen. Daher können sie sich nicht an der gleichen Stelle aufhalten.
|
Seite 11
S. 11, Aufgabe 3
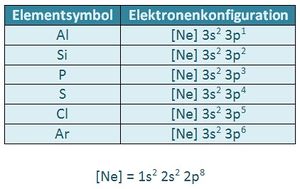
Es gibt immer drei p-Orbital, egal welche Schale (außer der ersten, K-Schale. Diese besteht nur aus einem s-Orbital). Da in jedem Orbital zwei Elektronen Platz finden können sich sowohl im 2p, als auch im 3p-Niveau maximal 6 Elektronen aufhalten. S. 11, Aufgabe 5
a) 2p7 ist unmöglich: Es existieren immer nur drei p-Orbitale. In jedem finden maximal zwei Elektronen Platz. Das p-Niveau (egal welcher Schale) kann daher immer nur mit maximal 6 Elektronen besetzt sein. |
S. 11, Aufgabe 2
Normalerweise besetzen die Elektronen die energieärmsten Niveaus. Durch Energiezufuhr können jedoch auch Energieniveaus besetzt werden, die energetisch betrachtet höher liegen.
S. 11, Aufgabe 4
Der Grundzustand wäre: 1s2 2s2 2p6. Ein Elektron aus dem 2p-Niveau befindet sich jedoch auf dem nächst höheren Niveau: 3s.
|
Seite 13
S. 11, Aufgabe 1
Durch die Hauptquantenzahl n,
|
S. 13, Aufgabe 2
An einem unbeeinflussten Atom sind die drei p-Orbitale (px, py und pz) als energetisch gleichwertig zu betrachten.
|