Blue Genes 2008
Inhaltsverzeichnis |
Über das Projekt
Lange Zeit war die „Gentechnik“ ein in der Öffentlichkeit kontrovers diskutiertes Teilgebiet der Biologie. Unvorstellbar schienen sowohl die Möglichkeiten als auch die Befürchtungen, die mit dieser vor einigen Jahrzehnten entwickelten Technik in Verbindung gebracht wurden. In den letzten Jahren nahm die Zahl der in der Öffentlichkeit geführten Diskussionen jedoch deutlich ab. Das ein oder andere Streitthema schaffte zwar den Sprung in die Massenmedien, z.B. das Embryonenschutzgesetz 2002, welches die Verwendung embryonaler Stammzellen für Forschungszwecke quasi unterbindet, oder die 0,9%-Grenze, die eine kleine Menge gentechnisch verändertes Material in den Ernteerträgen von Landwirten zulässt, bevor Lebensmittel als „gentechnisch verändert“ gekennzeichnet werden müssen, doch dass dem Einzelnen dabei klar geworden ist, welche Konsequenzen diese Entscheidungen haben, darf bezweifelt werden. Vielleicht, weil es gar nicht so einfach ist, über eine Technik zu urteilen, die noch so jung und deren Auswirkungen noch so unüberschaubar sind.
Mit dem Projekt „Blue Genes“ hat Roche Diagnostics die Möglichkeit geschaffen, gentechnische Verfahren in der Schule durchzuführen. Durch die praktische Auseinandersetzung mit diesem Thema besteht eine sehr viel größere Wahrscheinlichkeit, Interesse zu wecken und damit zu einer fundierten Meinung über die die Risiken und Chancen der Gentechnik zu gelangen.
In dieser Zusammenfassung sollen lediglich die Vorgehensweisen und Ergebnisse unseres Teams präsentiert werden. Für weiterführende Informationen zum Projekt und den theoretischen Grundlagen bietet sich die Hompage der Firma Roche an:
http://www.roche.de/diagnostics/biochemica/bluegenes
Team
Die Versuche wurden vom 26. – 27.02.08 im Natur- und Technikraum 136 vom Biologie-Leistungskurs 2007/2009 durchgeführt.
Theorie
Zur Erläuterung der Begriffe s. u.: Begriffserklärung.
„Blue Genes“ beinhaltet zwei Versuche:
- Beim ersten Versuch schneidet man ein Plasmid mit Restriktionsenzymen in mehrere, unterschiedlich lange Teile und trennt diese durch Gelelektrophorese auf.
- Beim zweiten Versuch schneidet man ein Plasmid mit Restriktionsenzymen lediglich an einer Stelle auf und fügt dort einen DNS-Abschnitt (lacZ-Gen) ein. Das lacZ-Gen enthält die Informationen zur Herstellung eines blauen Farbstoffs aus einer chemischen Vorstufe (X-Gal), die sich in dem Medium befindet, auf dem Bakterien nach dem Einschleusen des veränderten Plasmids zur Vermehrung aufgebracht werden.
Methoden
Zur Durchführung des Experiments müssen sehr kleine Mengen verschiedener Lösungen pipettiert werden. Die Mikroliterpipette ist daher unser wichtigstes Werkzeug gewesen, dessen Benutzung ein erhebliches Maß an Fingerspitzengefühl erfordert und vorher auch eingeübt werden muss.
Da an den Experimenten Enzyme beteiligt sind, deren Effektivität stark von der Temperatur abhängig ist, standen eine Reihe von Wasserbädern und Isoliergefäßen mit Eis zur optimalen Inkubation der Versuchsansätze bereit.
- Am Rande: Sehr spektakulär sind die Reaktionen von Trockeneis mit Wasser. Trockeneis ist Kohlenstoffdioxid, dass durch Druck und Abkühlung auf – 70°C in den festen Zustand überführt wird. Es dient der starken Kühlung empfindlicher Chemikalien oder auch Bakterien und bietet den Vorteil, bei Erwärmung sofort in den gasförmigen Zustand überzugehen ohne vorher flüssig zu werden (daher Trockeneis). Wasser würde Verpackungen etc. aufweichen und auch nicht die manchmal erforderlichen tiefen Temperaturen halten können.
- Wirft man kleine Stücken Trockeneis in Wasser, verdampft das Kohlenstoffdioxid unter Bildung großer Mengen Nebels auf der Wasseroberfläche, was zu dem im Bild dargestellten, ästhetischen Effekt führt.
- Am Rande: Sehr spektakulär sind die Reaktionen von Trockeneis mit Wasser. Trockeneis ist Kohlenstoffdioxid, dass durch Druck und Abkühlung auf – 70°C in den festen Zustand überführt wird. Es dient der starken Kühlung empfindlicher Chemikalien oder auch Bakterien und bietet den Vorteil, bei Erwärmung sofort in den gasförmigen Zustand überzugehen ohne vorher flüssig zu werden (daher Trockeneis). Wasser würde Verpackungen etc. aufweichen und auch nicht die manchmal erforderlichen tiefen Temperaturen halten können.
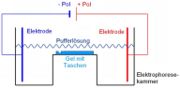
Zur Auftrennung von unterschiedlich langen DNS-Stücken wurde eine Gelektrophorese durchgeführt. Zur Herstellung des Gels verwendet man Agar-Agar, welches man mit viel Wasser aufkocht. Beim Abkühlen entsteht ähnlich wie bei Gelatine eine gelartige Substanz. In unserem Fall werden in die Gießform vor dem Erstarren noch „Kämme“ eingesetzt, so dass anschließend im Gel kleine Taschen vorhanden sind. In diese wird das aufzutrennende DNS-Gemisch gefüllt. Das gesamte Gel wird in eine Apparatur überführt, die mit einem Puffer gefüllt ist und zwei Metallelektroden enthält. Durch das Anlegen einer Spannung werden die DNS-Stücke zur positiven Elektrode gezogen, da die DNA selbst negativ geladen ist. Die Gelstruktur lässt kurze DNA-Stücke sehr schnell in Richtung positiver Elektrode wandern, lange DNA-Stücke dagegen „verheddern“ sich im Gel und kommen nur langsam voran.
Weder der Einbau des Gens lacZ in das Plasmid pUCD, noch die Einschleusung des Plasmids in die Bakterien gelingt häufig. Nur in einem Bruchteil der Fälle funktioniert diese Methode überhaupt. Daher ist es wichtig, die genetisch verschieden ausgestatteten Bakterien zu unterscheiden. Dies gelingt mit einem Trick: Das Plasmid pUCD enthält die Information, wie sich das Bakterium trotz Vorhandensein eines bestimmten Antibiotikums (Ampicillin) vermehren kann. Der Nährboden, auf dem sich die Bakterien später vermehren sollen, enthält Ampicillin. Daher müssen alle gewachsenen Bakterienkolonien auf ein Bakterium mit aufgenommenem Plasmid zurückgehen.
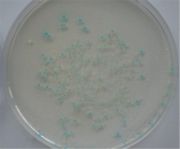
Ob das aufgenommenen Plasmid auch tatsächlich das Gen lacZ enthält, lässt sich sehr leicht erkennen. Da der Nährboden auch die Vorstufe (X-Gal) enthält, die mittels lacZ-Gen in einen blauen Farbstoff umgewandelt werden kann, müssen alle Bakterienkolonien, die das Plasmid incl. lacZ-Gen aufgenommen haben, blau erscheinen.
Ergebnisse
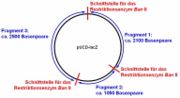
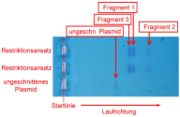
- Versuch 1: Das Plasmid, welches vom Restriktionsenzym Ban II an exakt drei Stellen geschnitten wird, besitzt insgesamt ca. 5600 Basenpaare (bp). Durch das Schneiden entstehen drei Bruchstücke unterschiedlicher Länge (s. Schema).
- Im kommentieren Detailausschnitt sind die drei unterschiedlich weit gewanderten DNA-Abschnitte nach der Anfärbung deutlich zu erkennen.
- Versuch 2: Bei zwei Gruppen konnten blaue Kolonien auf den Nährböden entdeckt werden. Hier hat sowohl der Einbau des lacZ-Gens in das pUCD-Plasmid, als auch die Aufnahme des pUCD-lacZ-Plasmids in die Bakterienzelle geklappt.
Begriffserklärung
Die DNS (engl. DNA) kann in einfachster Form als leiterartiges Gebilde dargestellt werden. Zwei Stränge aus einem Zucker-Phosphat-Gerüst (im Bild lediglich als schwarze Linien dargestellt) an denen vier verschiedene Basen sitzen (im Bild dunkelblau, hellblau, rot und gelb). Die Basen weisen eine bestimmte räumliche Struktur (im Bild Zacken und Rundungen) auf und jeweils zwei Basen passen exakt zusammen und bilden ein Basenpaar. Dadurch ergibt sich aus der Basenabfolge des einen Strangs automatisch die Basenabfolge des gegenüberliegenden Stranges. Man bezeichnet die beiden DNA-Stränge daher auch als komplementär. Die Reihenfolge der Basenpaare auf der DNS bestimmt nun (in manchen Fällen) bestimmte Eigenschaften des Lebewesens, das die DNS besitzt. Ähnlich wie bei einem geschriebenen Text die Reihenfolge der Buchstaben den Sinn des Textes erzeugt, erzeugt auf der DNS die Reihenfolge der Basen einen bestimmten „Sinn“. Änderungen in der Basenreihenfolge, oder das Einfügen von DNS-Abschnitten in eine bestehende DNS führen zu Veränderungen im Lebewesen. Beispielsweise führt der Einbau eines bestimmten DNS-Stücks in die DNS eines Bakteriums dazu, dass dieses Insulin herstellt, einen Stoff, der für das Bakterium keinerlei Bedeutung hat, aber im großen Maßstab aus den Bakterien gewonnen und zu einem Medikament für Menschen mit Diabetes verarbeitet werden kann.
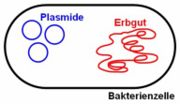
Plasmide sind ringförmige DNS-Stücke, die zusätzlich zum ebenfalls ringförmigen, aber wesentlich größeren, „Bakterienchromosom“ in der Bakterienzelle vorkommen können.
(Der Begriff „Bakterienchromosom“ wird zwar häufig verwendet, ist jedoch nicht korrekt, da ein Chromosom bei höheren Lebewesen eine andere Struktur aufweist.)
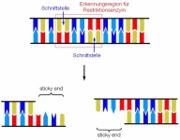
Restriktionsenzyme sind in der Lage eine ganz bestimmte Basenreihenfolge zu erkennen und die beiden Stränge versetzt zu schneiden. Dadurch entstehen am Ende jedes DNS-Doppelstrangs kurze, überlappende, einzelsträngige DNS-Abschnitte, die man als „sticky ends“ bezeichnet.