10d 2011 12: Unterschied zwischen den Versionen
| (18 dazwischenliegende Versionen von einem Benutzer werden nicht angezeigt) | |||
| Zeile 7: | Zeile 7: | ||
=== Zum Unterricht === | === Zum Unterricht === | ||
* Schematische Darstellung der molekularen Ursachen für den "Speichel-Stärke-Test" als [[media:Bio10_SpeichelStärkeV.pdf|pdf-Datei]]. | * Schematische Darstellung der molekularen Ursachen für den "Speichel-Stärke-Test" als [[media:Bio10_SpeichelStärkeV.pdf|pdf-Datei]]. | ||
| − | * Versuchsprotokoll zum "Eipraktikum" vom 13.10.2011 als [[media: | + | * Versuchsprotokoll zum "Eipraktikum" vom 13.10.2011 als [[media:Bio10_EiweißDenat_VP_V2.pdf|pdf-Datei]]. |
<br> | <br> | ||
| Zeile 20: | Zeile 20: | ||
| BreM || Mistel || 14.05. || <span style="color:#00EE00;"> '''V''' </span> | | BreM || Mistel || 14.05. || <span style="color:#00EE00;"> '''V''' </span> | ||
|- | |- | ||
| − | | EllB || Einsiedlerkrebs + Seeanemone || | + | | EllB || Einsiedlerkrebs + Seeanemone || 28.06. || <span style="color:#00EE00;"> '''V''' </span> |
|- | |- | ||
| EllC || Hund-Floh || 21.05. || <span style="color:#00EE00;"> '''V''' </span> | | EllC || Hund-Floh || 21.05. || <span style="color:#00EE00;"> '''V''' </span> | ||
| Zeile 28: | Zeile 28: | ||
| HemM || Venusfliegenfalle || 21.05. || <span style="color:#00EE00;"> '''V''' </span> | | HemM || Venusfliegenfalle || 21.05. || <span style="color:#00EE00;"> '''V''' </span> | ||
|- | |- | ||
| − | | HetM || Putzerfisch || | + | | HetM || Putzerfisch || 18.06. || <span style="color:#00EE00;"> '''V''' </span> |
|- | |- | ||
| (JilM) || ''Cymothoa exigua'' || 24.05. || <span style="color:#00EE00;"> '''V''' </span> | | (JilM) || ''Cymothoa exigua'' || 24.05. || <span style="color:#00EE00;"> '''V''' </span> | ||
| Zeile 34: | Zeile 34: | ||
| KraC || Gelbschnabelhacker und Gnu || 24.05. || <span style="color:#00EE00;"> '''V''' </span> | | KraC || Gelbschnabelhacker und Gnu || 24.05. || <span style="color:#00EE00;"> '''V''' </span> | ||
|- | |- | ||
| − | | PotM || Clownfisch und Seeanemone || 11.06. || <span style="color:# | + | | PotM || Clownfisch und Seeanemone || 11.06. || <span style="color:#00EE00;"> '''V''' </span> |
|- | |- | ||
| − | | ReiF || Stern v. Madagaskar und Schwärmer || 11.06. || <span style="color:# | + | | ReiF || Stern v. Madagaskar und Schwärmer || 11.06. || <span style="color:#00EE00;"> '''V''' </span> |
|- | |- | ||
| − | | ReuJ || Mimese || | + | | ReuJ || Mimese || 18.06. || <span style="color:#00EE00;"> '''V''' </span> |
|- | |- | ||
| − | | SmiM || Mimikry || 14.06. || <span style="color:# | + | | SmiM || Mimikry || 14.06. || <span style="color:#00EE00;"> '''V''' </span> |
|- | |- | ||
| − | | EisF || Mykorrhiza bei Orchideen || | + | | EisF || Mykorrhiza bei Orchideen || 28.06. || <span style="color:#00EE00;"> '''V''' </span> |
|} | |} | ||
</center> | </center> | ||
| Zeile 80: | Zeile 80: | ||
{|width=97%| style="background-color:#C6E2FF; padding:0.3em" | {|width=97%| style="background-color:#C6E2FF; padding:0.3em" | ||
| valign="top" | | | valign="top" | | ||
| − | === | + | === Grundwissen === |
| − | + | ||
| − | '' | + | '''Eine noch nicht ganz fertig gestellte Seite zum Grundwissen des Stoffes in der 10. Jahrgangsstufe (NTG) findet ihr unter folgendem ''link'':''' |
<br> | <br> | ||
| − | + | http://wikis.zum.de/rmg/Grundwissen_Chemie:_10._Klasse_NTG | |
| − | + | ||
| − | + | ||
| − | + | ||
| − | + | ||
| − | + | ||
| − | + | ||
| − | + | ||
| − | + | ||
| − | + | ||
| − | + | ||
| − | + | ||
| − | + | ||
| − | + | ||
| − | + | ||
| − | + | ||
| − | + | ||
| − | + | ||
| − | + | ||
| − | + | ||
| − | + | ||
<br> | <br> | ||
| + | | valign="top" width="50%"| | ||
| + | === Externe links === | ||
| + | * Wie man gute PowerPoint-Präsentation gestaltet: [http://www.kreisgymnasium-neuenburg.de/unterricht/itg/tipps-fuer-gute-praesentationen-mit-powerpoint/] | ||
| − | |||
<br> | <br> | ||
| − | |||
| − | |||
| + | <span style="color:#FF0000;"> '''Neu, 03.07.:''' </span> | ||
| + | |||
| + | === Skript: "Kap. 21 Biomoleküle" === | ||
<br> | <br> | ||
| − | + | 21.1 Kohlenhydrate ''+''<br> | |
| − | + | 21.2 verknüpfte Kohlenhydrate ''als [[media:30_Skript_Biomolek_KH_V2.pdf|pdf-Datei]]''<br> | |
| − | + | 21.3 Fette ''als [[media:C10NTG_Biomolek_Fett.pdf|pdf-Datei]]''<br> | |
| + | 21.4 Proteine ''als [[media:C10NTG_Biomolek_Prot.pdf|pdf-Datei]]'' | ||
|} | |} | ||
| Zeile 133: | Zeile 116: | ||
* '''"Eine Aldehydgruppe ''"verschwindet"''"''' vom 27.03.12 als [[media:Ü_GlukStärk_Fehl.pdf|pdf-Datei]] | * '''"Eine Aldehydgruppe ''"verschwindet"''"''' vom 27.03.12 als [[media:Ü_GlukStärk_Fehl.pdf|pdf-Datei]] | ||
* '''"Die Carboxylgruppe"''' vom 15.05.12: Anleitung + Hilfekärtchen als [[media:Ü_Carboxy.pdf|pdf-Datei]] | * '''"Die Carboxylgruppe"''' vom 15.05.12: Anleitung + Hilfekärtchen als [[media:Ü_Carboxy.pdf|pdf-Datei]] | ||
| + | <span style="color:#FF0000;"> '''Neu, 19.06.:''' </span> | ||
| + | * '''"Schöpfen"''' vom 19.06.12 als [[media:Ü_Schöpfen.pdf|pdf-Datei]] | ||
| valign="top" width="50%"| | | valign="top" width="50%"| | ||
| Zeile 307: | Zeile 292: | ||
Herkunft: {{versteckt|http://de.wikipedia.org/wiki/Hexansäure]}} | Herkunft: {{versteckt|http://de.wikipedia.org/wiki/Hexansäure]}} | ||
<br><br> | <br><br> | ||
| + | </div><br> | ||
| + | |||
| + | === Die Salze der organische Säuren === | ||
| + | |||
| + | <div style="border: 1px solid #FF0000; background-color:#FF0000; font-size:1px; height:8px; border-bottom:1px solid #FF0000"> | ||
| + | </div> | ||
| + | <div style="border: 1px solid #FF0000; padding:7px;"> | ||
| + | == Auch organische Säuren bilden mit Laugen Salze == | ||
| + | |||
| + | Die oben genannten Säuren können genau wie anorganische Säuren mit Laugen unter Bildung von Wasser und einem Salz reagieren. Anorganisches Bsp.: <br> | ||
| + | 2 NaOH + H<sub>2</sub>SO<sub>4</sub> <math>\rightarrow</math> 2 H<sub>2</sub>O + Na<sub>2</sub>SO<sub>4</sub> (Natrium'''sulfat'''). <br> | ||
| + | : 1. Formuliere im gleichen Stil die Gleichung für folgende Reaktionen! | ||
| + | : 2. Recherchiere anschließend die Namen der Salze, die sich häufig vom Trivialnamen der Säure ableiten! | ||
| + | <br><br> | ||
| + | |||
| + | '''Calciumhydroxid (Ca(OH)<sub>2</sub>) reagiert mit Oxalsäure (Ethandisäure)''' | ||
| + | |||
| + | Gleichung: | ||
| + | {{versteckt|[[Datei:CaOH2undOxalsäure.jpg|600px]]}} | ||
| + | <br> | ||
| + | Name des Salzes: | ||
| + | {{versteckt|Calcium'''oxalat'''}} | ||
| + | |||
| + | <br><br><br> | ||
| + | |||
| + | '''Calciumhydroxid reagiert mit Zitronensäure (2-Hydroxy-1,2,3-tricarbonsäure)''' | ||
| + | |||
| + | Gleichung: | ||
| + | {{versteckt|[[Datei:CaOH2undZitronensäure.jpg|600px]]}} | ||
| + | <br> | ||
| + | Name des Salzes: | ||
| + | {{versteckt|Calcium'''citrat'''}} | ||
| + | |||
| + | <br><br><br> | ||
| + | |||
| + | '''Natriumhydroxid reagiert mit Milchsäure (2-Hydroxy-propansäure)''' | ||
| + | |||
| + | Gleichung: | ||
| + | {{versteckt|[[Datei:NaOHundMilchäure.jpg|600px]]}} | ||
| + | <br> | ||
| + | Name des Salzes: | ||
| + | {{versteckt|Natrium'''lactat'''}} | ||
| + | |||
| + | </div><br> | ||
| + | |||
| + | === Laptopstunde Nr. 3 === | ||
| + | |||
| + | <div style="border: 1px solid #FF0000; background-color:#FF0000; font-size:1px; height:8px; border-bottom:1px solid #FF0000"> | ||
| + | </div> | ||
| + | <div style="border: 1px solid #FF0000; padding:7px;"> | ||
| + | == Info zur Namensgebung von Estern == | ||
| + | |||
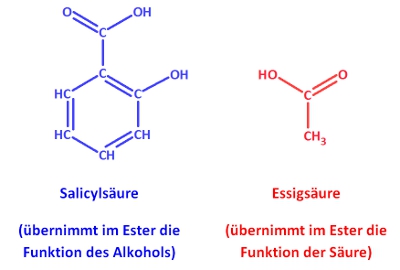
| + | Es existieren verschiedene Möglichkeiten zur Benennung von Estern. Die wohl einfachste Variante nennt zunächst die <span style="color:#FF0000;">'''Säure'''</span>, dann den <span style="color:#0000FF;">'''Alkohol''' (mit ...yl anstatt ...ol als Endung)</span> und hängt '''...ester''' an, Bsp.: | ||
| + | <br> | ||
| + | [[Datei:Essigsäureethylester_farbig.jpg|300px]] | ||
| + | <br> | ||
| + | Nach einer anderen Variante wird zuerst der <span style="color:#0000FF;">'''Alkohol''' (mit ...yl anstatt ...ol als Endung)</span> genannt und dann der <span style="color:#FF0000;">'''SäureREST'''</span> angehängt. Die Endung '''...ester''' entfällt, Bsp.: | ||
| + | <br> | ||
| + | [[Datei:Essigsäureethylester_farbig2.jpg|300px]] | ||
| + | <br> | ||
| + | </div><br> | ||
| + | |||
| + | <div style="border: 1px solid #FF0000; background-color:#FF0000; font-size:1px; height:8px; border-bottom:1px solid #FF0000"> | ||
| + | </div> | ||
| + | <div style="border: 1px solid #FF0000; padding:7px;"> | ||
| + | == Aufgaben zum Thema "Ester" == | ||
| + | |||
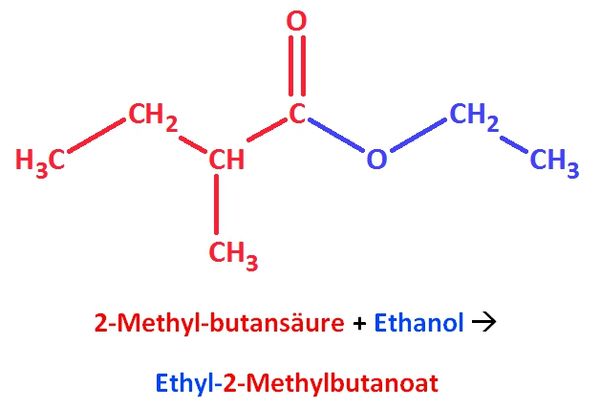
| + | '''1. Ein wichtiger Bestandteil des Ananasaromas ist der 2-Methylbuttersäureethylester.'''<br> | ||
| + | |||
| + | : a) Zeichne diesen Ester und bestimme den systematischen Namen! | ||
| + | <br> | ||
| + | {{versteckt|[[Datei:Ananasester.jpg|600px]]}} | ||
| + | <br> | ||
| + | : b) Recherchiere weitere Vorkommen dieses Esters! | ||
| + | {{versteckt|http://de.wikipedia.org/wiki/Ethyl-2-methylbutanoat}} | ||
| + | |||
| + | <br><br> | ||
| + | |||
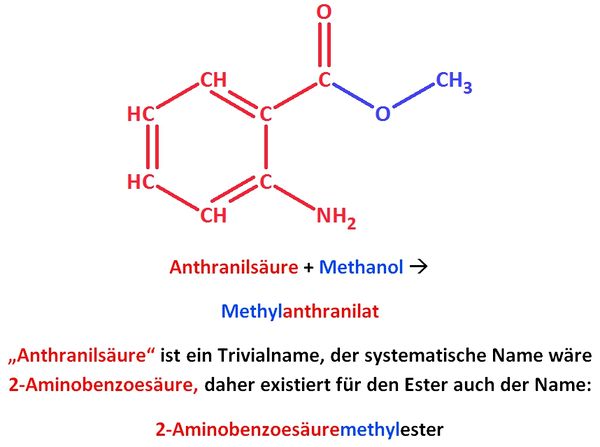
| + | '''2. Die folgende Abbidlung zeigt die Anthranilsäure. Diese kann mit Methanol einen Ester bilden.'''<br> | ||
| + | [[Datei:Anthranilic acid structure.svg|200px|Strukturformel von Anthranilsäure]] | ||
| + | <br> | ||
| + | : a) Zeichne diesen Ester und bestimme den Namen! | ||
| + | <br> | ||
| + | {{versteckt|[[Datei:Anthranilsäuremethylester_farbig.jpg|600px]]}} | ||
| + | <br> | ||
| + | : b) Recherchiere Vorkommen, Verwendung und Aggregatszustand dieses Esters! | ||
| + | {{versteckt|http://de.wikipedia.org/wiki/Methylanthranilat}} | ||
| + | </div><br> | ||
| + | |||
| + | === Laptopstunde Nr. 4 === | ||
| + | |||
| + | <div style="border: 1px solid #FF0000; background-color:#FF0000; font-size:1px; height:8px; border-bottom:1px solid #FF0000"> | ||
| + | </div> | ||
| + | <div style="border: 1px solid #FF0000; padding:7px;"> | ||
| + | == Acetylsalicylsäure (ASS) ist Bestandteil des bekanntesten Medikaments der Welt: Aspirin. == | ||
| + | |||
| + | a) Recherchiere die Valenzstrichformel! <br> | ||
| + | {{versteckt|[[Datei:Acetylsalicylsäure2.svg|200px]]}} | ||
| + | <br> | ||
| + | b) Bei ASS handelt es sich um einen Ester! Durch Hydrolyse kann man diesen Ester spalten. Zeichne in ChemSketch die beiden entstehenden Produkte und lasse sie benennen! <br> | ||
| + | {{versteckt|[[Datei:4_ASS_Spaltprodukte.jpg|500px]]}} | ||
| + | <br> | ||
| + | c) Gib auch an, unter welchen Reaktionsbedingungen man die Esterhydrolyse durchführen kann! <br> | ||
| + | {{versteckt|Kochen mit Natronlauge (oder Salzsäure)}} | ||
| + | <br> | ||
| + | |||
| + | </div><br> | ||
| + | |||
| + | <div style="border: 1px solid #FF0000; background-color:#FF0000; font-size:1px; height:8px; border-bottom:1px solid #FF0000"> | ||
| + | </div> | ||
| + | <div style="border: 1px solid #FF0000; padding:7px;"> | ||
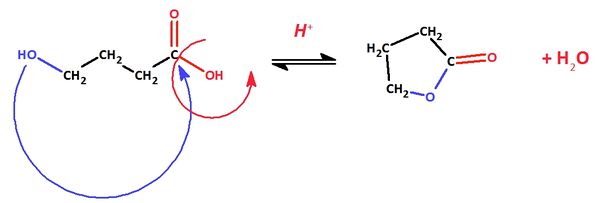
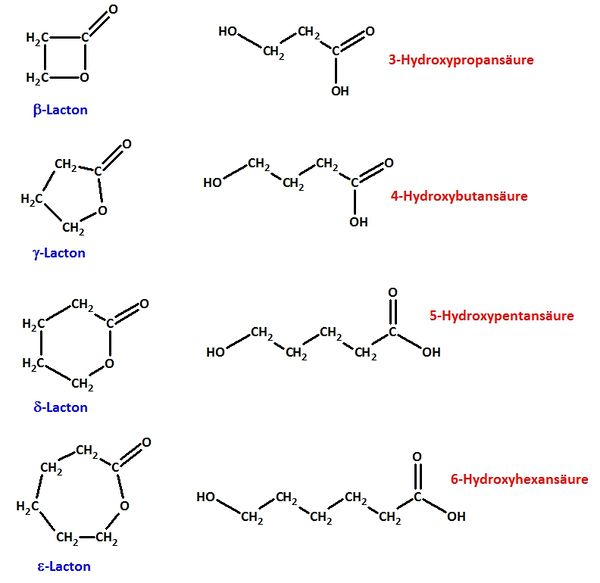
| + | == Ein Ester entsteht durch die Reaktion einer Hydroxgruppe mit einer Carboxygruppe. Befindet sich an einer C-Kette sowohl eine Hydroxygruppe als auch eine Carboxygruppe, kommt es zu einem intramolekularen Ringschluss (das Molekül reagiert mit sich selbst). Die entstehenden intramolekularen Ester nennt man Lactone. == | ||
| + | |||
| + | a) Formuliere die Reaktion von 4-Hydroxybutansäure zu einem Lacton mit Valenzstrichformeln in ChemSketch! <br> | ||
| + | {{versteckt|[[Datei:4_4Hydroxybutansä_Lacton.jpg|600px]]}} | ||
| + | <br> | ||
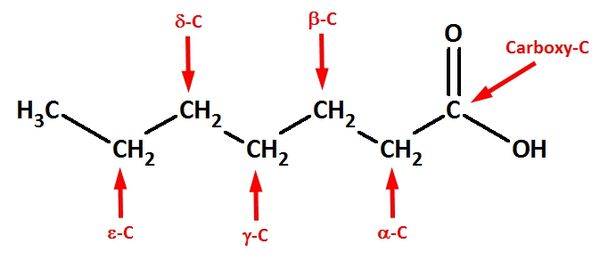
| + | b) Im Wikipedia-Artikel „Lactone“ sind im Bild rechts oben jeweils die einfachsten <math>\beta</math>-, <math>\gamma</math>-, <math>\delta</math>-, <math>\varepsilon</math>-Lactone dargestellt.<br> | ||
| + | ba) Erkläre die Bedeutung der griechischen Buchstabens! <br> | ||
| + | {{versteckt|Lactone sind intramolekulare Ester, die von Molekülen gebildet werden, die im geöffneten Zustand sowohl eine Hydroxy- wie auch Carboxygruppe besitzen. Die griechischen Buchstaben geben Auskunft über die Stellung der Hydroxygruppe zur Carboxygruppe: Ist die Hydroxygruppe an einem C-Atom gebunden, das direkt neben dem Carboxy-C-Atom liegt, spricht man von einer <math>\alpha</math>-Hydroxycarbonsäure (diese können keine intramolekularen Ester bilden!). Hängt die Hydroxgruppe an einem C-Atom, das zwei C-Atome vom Carboxy-C-Atom entfernt ist, spricht von <math>\beta</math>-Hydroxycarbonsäuren (diese bilden <math>\beta</math>-Lactone) usw. }} <br> | ||
| + | Veranschaulichung: <br> | ||
| + | {{versteckt|[[Datei:4_Hydroxycarbonsäuren_a_e.jpg|600px]]}} <br> | ||
| + | bb) Zeichne von allen abgebildeten Lactonen das geöffnete Molekül (die „Hydroxy-Carbonsäuren“) und benenne sie systematisch! <br> | ||
| + | {{versteckt|[[Datei:4_Lactone_a_e.jpg|600px]]}} <br> | ||
| + | |||
| + | </div><br> | ||
| + | |||
| + | <div style="border: 1px solid #FF0000; background-color:#FF0000; font-size:1px; height:8px; border-bottom:1px solid #FF0000"> | ||
| + | </div> | ||
| + | <div style="border: 1px solid #FF0000; padding:7px;"> | ||
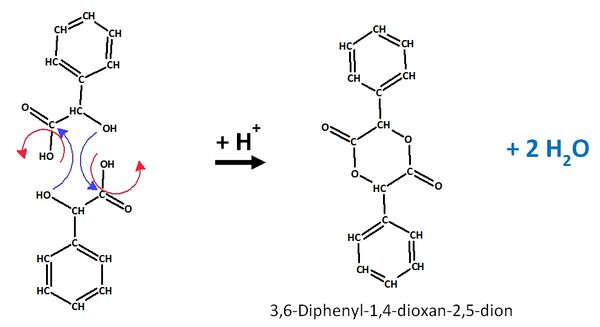
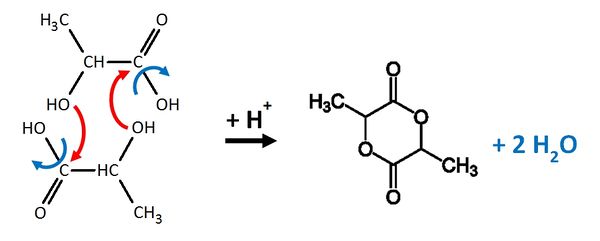
| + | == Zwei Milchsäuremoleküle können nach folgendem Mechanismus zu einem sogenannte Lactid reagieren: == | ||
| + | [[Datei:2Milchsäure_Lactid.jpg|600px]] | ||
| + | <br><br> | ||
| + | a) Recherchiere die Valenzstrichformel für Mandelsäure! <br> | ||
| + | {{versteckt|[[Datei:Mandelic acid.png|200px]]}} | ||
| + | <br> | ||
| + | b) Stelle die Bildung des Mandelsäure-Lactids genau so dar, wie oben die Reaktion zweier Milchsäuremoleküle zum Lactid! <br> | ||
| + | {{versteckt|[[Datei:4_2Mandelsäure_Lactid.jpg|600px]]}} | ||
| + | <br> | ||
| + | |||
</div><br> | </div><br> | ||
Aktuelle Version vom 5. Juni 2016, 10:48 Uhr
Biologie
Zum Unterricht
Referate
|
Externe links
Präsentationstechnik
Organisatorisches zu den Referaten
|
Chemie
GrundwissenEine noch nicht ganz fertig gestellte Seite zum Grundwissen des Stoffes in der 10. Jahrgangsstufe (NTG) findet ihr unter folgendem link:
|
Externe links
Neu, 03.07.: Skript: "Kap. 21 Biomoleküle"
|
Versuchsprotokolle zu den Übungen
Neu, 19.06.:
|
Lösungen zu Aufgaben
|
Arbeit mit dem Laptop
Chemie
Lösungen zu den Aufgaben
Durch Klicken auf Anzeigen wird die Lösung angezeigt!
Buch, S. 112 Aufgabe 4
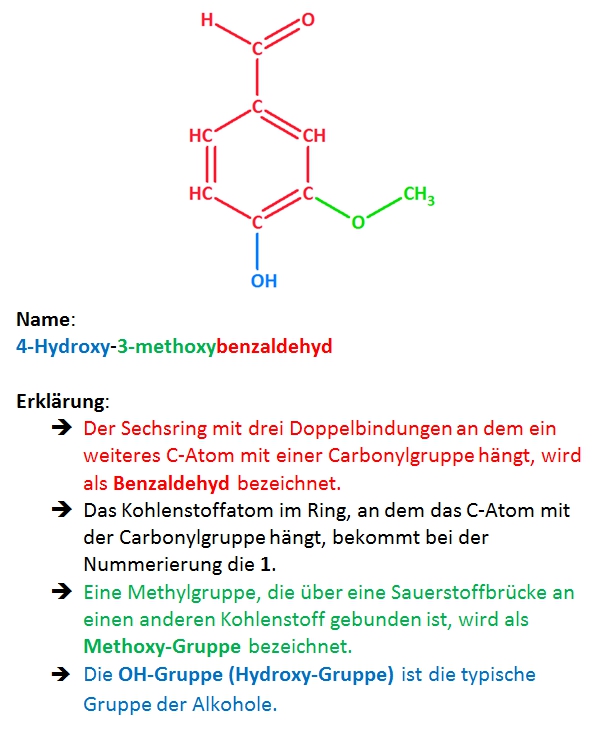
1. Zeichne die Strukturformel von Vanillin in ChemSketch und gib den systematischen Namen an!
Strukturformel von Vanillin:
Erklärungen zur Namensgebung:
2. Vanillin ist in der Frucht der echten Vanille enthalten. Der weltgrößte Vanille-Einkäufer ist Coca-Cola. Fasse den Wikipedia-Artikel "Gewürzvanille" kurz zusammen!
Zum Artikel: http://de.wikipedia.org/wiki/Gewürzvanille
3. Mit dem milden Oxidationsmittel NAD+ kann Vanillin zur Vanillinsäure oxidiert werden. Zeichne die Strukturformel!
Strukturformel von Vanillinsäure:
Erklärung:
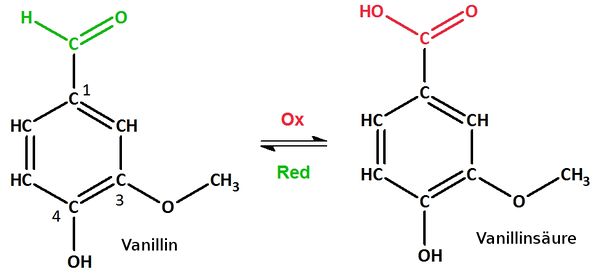
Mit milden Oxidationsmitteln können grundsätzlich primäre und sekundäre Alkohole oder endständige Carbonylgruppen (Aldehyde) oxidiert werden. Bei der 4-Hydroxygruppe handelt es sich allerdings um einen tertiären Alkohol. Hier kann keine Oxidation stattfinden. Es bleibt also nur die Carbonylgruppe die zu einer Carboxygruppe oxidiert werden kann: 4-Hydroxy-3-methoxybenzoesäure
Buch, S. 112 Aufgabe 7
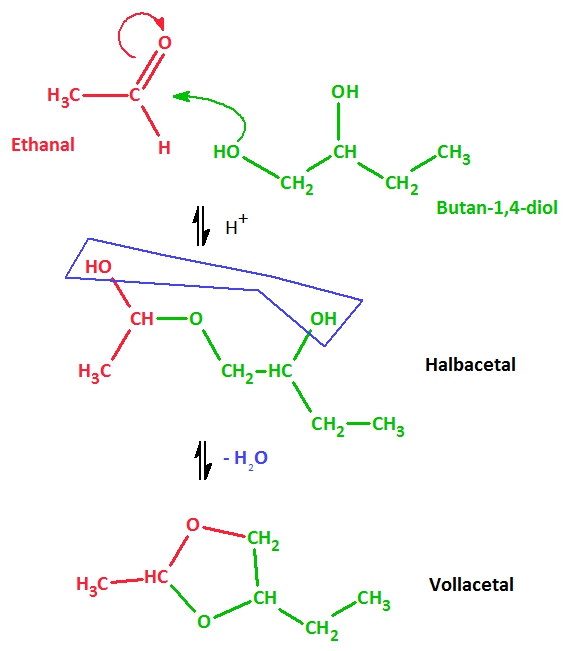
1. Stelle die Reaktionsgleichung für die Bildung eines Vollacetals aus Butan-1,2-diol und Ethanal auf (inkl. Strukturformeln)!
Reaktionsgleichung mit Valenzstrichformeln:
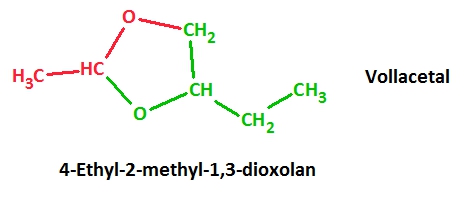
2. Lasse das Produkt benennen!
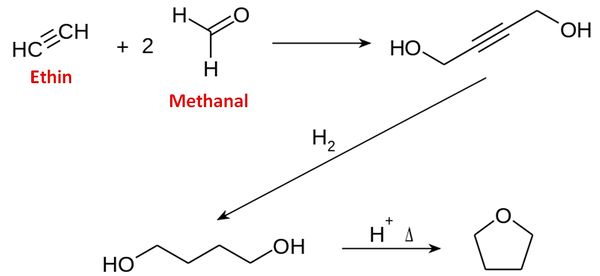
3. Bei dem Produkt handelt es sich um ein Dioxolan, abgeleitet von Oxolan (Tetrahydrofuran). Recherchiere das Herstellungsverfahren für Oxolan nach Reppe! Beschreibe dieses Verfahren unter Verwendung der SYSTEMATISCHEN Namen der beteiligten Stoffe!
link zum Wikipedia-Eintrag: http://de.wikipedia.org/wiki/Oxolan
Beschreibung unter Verwendung der systematischen Namen:
Buch, S. 112 Aufgabe 9
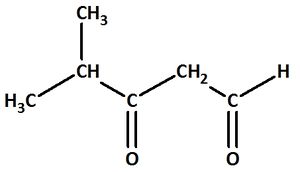
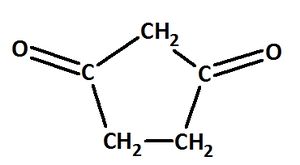
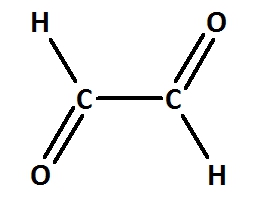
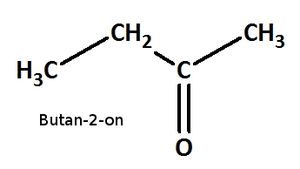
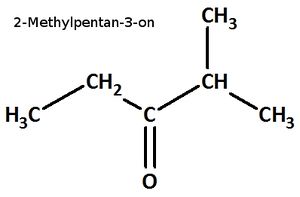
Benenne die folgenden Carbonylverbindungen!
heißt:
heißt:
heißt:
Buch, S. 112 Aufgabe 11
Es existieren die Trivialnamen "Methylethylketon" und "Isopropylethylketon". Zeichnet die Halbstrukturformel dieser Verbindung und benennt die Stoffe mit dem systematischen Namen!
Hilfe: Die Trivialnamen werden folgendermaßen abgeleitet: Man betrachtet das Carbonyl-C-Atom und benennt zuerst den einen organischen Rest, dann den anderen und hängt schließlich ...keton an,
Bsp.: Butylpropylketon
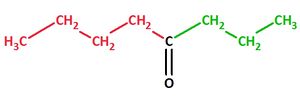
Methylethylketon, Formel und systematischer Name:
Isopropylethylketon, Formel und systematischer Name:
Laptopstunde Nr. 2
Für viele Säuren existieren Trivialnamen. Zeichne die folgenden Säuren zunächst in ChemSketch, überprüfe mit Hilfe der "Benennungsfunktion" deine gezeichneten Formeln und recherchiere dann im Internet nach den Trivialnamen! Finde auch heraus, WARUM die Stoffe diesen Trivialnamen besitzen!
Hinweis: Normalerweise bedeutet die Endung ...säure, dass am letzten C-Atom der Kette eine Carboxygruppe (also eine Carbonyl- und eine Hydroxy-Gruppe hängt.
Bsp.: Butansäure
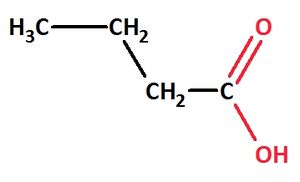
Gelegentlich wird aber auch die Endung ...carbonsäure verwendet. In diesem Fall zählt man das C-Atom, an dem die Carbonyl- und Hydroxygruppe hängt, zur funktionellen Gruppe dazu.
Bsp.: Methandicarbonsäure
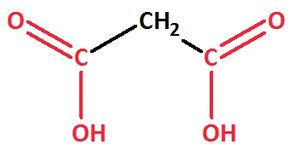
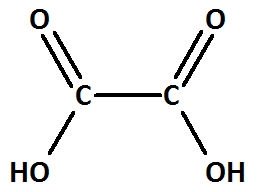
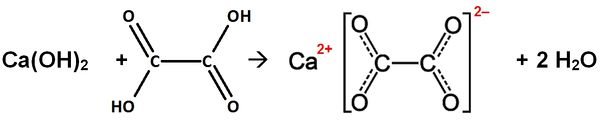
Ethandisäure:
Valenzstrichformel:
Trivialname:
Herkunft:
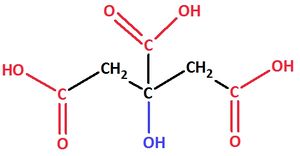
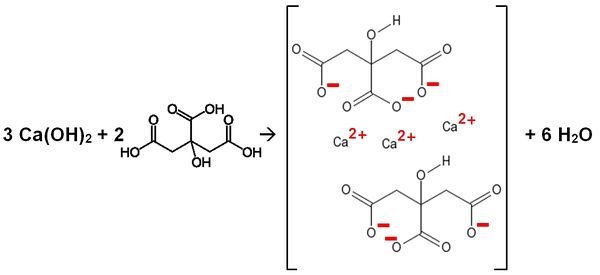
2-Hydroxypropan-1,2,3-tricarbonsäure
Valenzstrichformel:
Trivialname:
Herkunft:
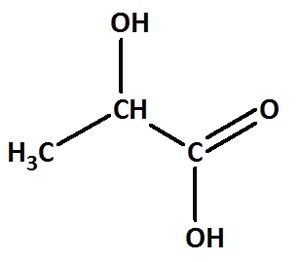
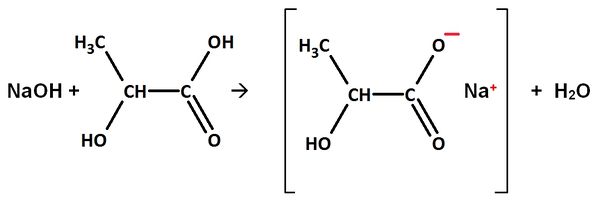
2-Hydroxpropansäure:
Valenzstrichformel:
Trivialname:
Herkunft:
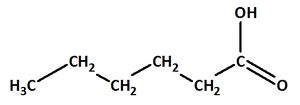
Hexansäure:
Valenzstrichformel:
Trivialname:
Herkunft:
Die Salze der organische Säuren
Auch organische Säuren bilden mit Laugen Salze
Die oben genannten Säuren können genau wie anorganische Säuren mit Laugen unter Bildung von Wasser und einem Salz reagieren. Anorganisches Bsp.:
2 NaOH + H2SO4 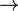 2 H2O + Na2SO4 (Natriumsulfat).
2 H2O + Na2SO4 (Natriumsulfat).
- 1. Formuliere im gleichen Stil die Gleichung für folgende Reaktionen!
- 2. Recherchiere anschließend die Namen der Salze, die sich häufig vom Trivialnamen der Säure ableiten!
Calciumhydroxid (Ca(OH)2) reagiert mit Oxalsäure (Ethandisäure)
Gleichung:
Name des Salzes:
Calciumhydroxid reagiert mit Zitronensäure (2-Hydroxy-1,2,3-tricarbonsäure)
Gleichung:
Name des Salzes:
Natriumhydroxid reagiert mit Milchsäure (2-Hydroxy-propansäure)
Gleichung:
Name des Salzes:
Laptopstunde Nr. 3
Info zur Namensgebung von Estern
Es existieren verschiedene Möglichkeiten zur Benennung von Estern. Die wohl einfachste Variante nennt zunächst die Säure, dann den Alkohol (mit ...yl anstatt ...ol als Endung) und hängt ...ester an, Bsp.:
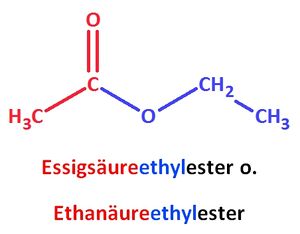
Nach einer anderen Variante wird zuerst der Alkohol (mit ...yl anstatt ...ol als Endung) genannt und dann der SäureREST angehängt. Die Endung ...ester entfällt, Bsp.:
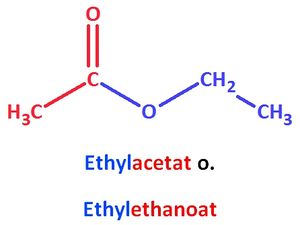
Aufgaben zum Thema "Ester"
1. Ein wichtiger Bestandteil des Ananasaromas ist der 2-Methylbuttersäureethylester.
- a) Zeichne diesen Ester und bestimme den systematischen Namen!
- b) Recherchiere weitere Vorkommen dieses Esters!
2. Die folgende Abbidlung zeigt die Anthranilsäure. Diese kann mit Methanol einen Ester bilden.
Strukturformel von Anthranilsäure
- a) Zeichne diesen Ester und bestimme den Namen!
- b) Recherchiere Vorkommen, Verwendung und Aggregatszustand dieses Esters!
Laptopstunde Nr. 4
Acetylsalicylsäure (ASS) ist Bestandteil des bekanntesten Medikaments der Welt: Aspirin.
a) Recherchiere die Valenzstrichformel!
b) Bei ASS handelt es sich um einen Ester! Durch Hydrolyse kann man diesen Ester spalten. Zeichne in ChemSketch die beiden entstehenden Produkte und lasse sie benennen!
c) Gib auch an, unter welchen Reaktionsbedingungen man die Esterhydrolyse durchführen kann!
Ein Ester entsteht durch die Reaktion einer Hydroxgruppe mit einer Carboxygruppe. Befindet sich an einer C-Kette sowohl eine Hydroxygruppe als auch eine Carboxygruppe, kommt es zu einem intramolekularen Ringschluss (das Molekül reagiert mit sich selbst). Die entstehenden intramolekularen Ester nennt man Lactone.
a) Formuliere die Reaktion von 4-Hydroxybutansäure zu einem Lacton mit Valenzstrichformeln in ChemSketch!
b) Im Wikipedia-Artikel „Lactone“ sind im Bild rechts oben jeweils die einfachsten 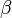 -,
-, 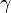 -,
-, 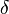 -,
-,  -Lactone dargestellt.
-Lactone dargestellt.
ba) Erkläre die Bedeutung der griechischen Buchstabens!
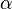 -Hydroxycarbonsäure (diese können keine intramolekularen Ester bilden!). Hängt die Hydroxgruppe an einem C-Atom, das zwei C-Atome vom Carboxy-C-Atom entfernt ist, spricht von
-Hydroxycarbonsäure (diese können keine intramolekularen Ester bilden!). Hängt die Hydroxgruppe an einem C-Atom, das zwei C-Atome vom Carboxy-C-Atom entfernt ist, spricht von 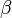 -Hydroxycarbonsäuren (diese bilden
-Hydroxycarbonsäuren (diese bilden 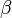 -Lactone) usw.
-Lactone) usw. Veranschaulichung:
bb) Zeichne von allen abgebildeten Lactonen das geöffnete Molekül (die „Hydroxy-Carbonsäuren“) und benenne sie systematisch!
Zwei Milchsäuremoleküle können nach folgendem Mechanismus zu einem sogenannte Lactid reagieren:
a) Recherchiere die Valenzstrichformel für Mandelsäure!
b) Stelle die Bildung des Mandelsäure-Lactids genau so dar, wie oben die Reaktion zweier Milchsäuremoleküle zum Lactid!